摘要
牙菌斑是一种结构和功能上有组织的生物膜。菌斑以有序的方式形成,并有不同的微生物组成,在健康情况下,随着时间的推移保持相对稳定(微生物稳态)。患病部位的优势种与健康部位的优势种不同,尽管推定病原体在正常部位通常可以少量检测到。在龋齿中,尽管其他具有相关性状的物种可能参与其中,但产酸和耐酸物种(如变形链球菌和乳酸杆菌)的群落优势正在发生转变。控制龋齿的策略可能包括抑制生物膜的形成(例如防止龋齿细菌的附着,操纵细胞信号机制,传递有效的抗菌剂,等等),或增强宿主防御。此外,这些更传统的方法可以通过干扰使龋齿细菌逃脱正常的稳态机制的因素而扩大,这种机制限制了龋齿细菌在菌斑中的生长,并与与健康相关的生物体竞争。证据表明,斑块中正常的低pH条件选择变形链球菌和乳酸杆菌。因此,通过在零食中使用代谢抑制剂和非发酵人工甜味剂来抑制糖的分解代谢和酸的产生,或者刺激唾液的流动,可以帮助维持斑块内的稳态。我们将会提出一些论点,认为对生态原则的理解将会使我们在控制龋病方面采取更全面的方法。
介绍
牙菌斑是在牙齿表面发现的微生物群落,作为生物膜,嵌入宿主和细菌来源的聚合物基质中[1.,2.].与临床相关的事实是,生物膜对抗菌药物的敏感性较低,而微生物群落可表现出增强的致病性(致病协同作用)[3.]。菌斑生物膜的结构可能限制抗菌剂的渗透,而在表面生长的细菌生长缓慢并表现出新的表型,其结果之一是对抑制剂的敏感性降低[4.].菌斑是天然的,有助于宿主生理和防御的正常发展[5.].
牙菌斑生物膜的研制
牙菌斑通过一系列有序的事件形成,形成一个结构和功能上有组织、物种丰富的微生物群落[2.].斑块形成的不同阶段包括:获得性膜形成;可逆粘附是指细胞表面和细胞膜之间弱的远程物理化学相互作用,可导致更强的粘附素受体介导的粘附;共粘附导致次级定殖细胞附着在已附着的细胞上(Cisar -本研讨会)[6.];增殖和生物膜形成(包括胞外多糖的合成),有时还能分离。对细菌粘附和共粘附机制的认识的增加可能导致控制或影响生物膜形成模式的策略(Cisar -本次研讨会)。可以合成类似物来阻断粘附素受体的粘附或共粘附,并且可以对定植表面的性质进行化学修饰,使其不利于微生物定植。然而,细胞可以表达多种类型的粘连素[7.,8.]因此,即使一种主要的粘附素被阻断,也可以调用其他附着机制。此外,尽管粘附对于定植是必要的,但一个物种在混合培养生物膜(如牙菌斑)中的最终比例最终将取决于一个有机体生长和超越相邻细胞的能力。
一旦形成,斑块顶极群落的整体组成是多样化的,在单个地点可以检测到许多物种。分子生态学方法从空斑样本中扩增16S rRNA基因,鉴定出>600细菌和Archae分类群,其中约50%目前无法培养[9].一旦菌斑形成,其在一个地点的物种组成的特点是,在一定程度上的稳定或平衡的组成物种,尽管定期轻微的环境压力,如饮食成分,口腔卫生,宿主防御,唾液流动的每日变化等。这个稳定(称为微生物体内平衡)这并不是由于居住生物体之间的任何生物差异,而是由于许多微生物相互作用所施加的平衡,包括协同作用和拮抗作用的例子[10].这些包括传统的生化相互作用,如分解复杂的宿主糖蛋白和形成食物链所必需的,但除此之外,更微妙的细胞-细胞信号也会发生。这种信号传递可以导致微生物群落内协调的基因表达,这些信号传递策略目前被视为新疗法的潜在靶点[11,12].
牙菌斑的扰动
在任何生态系统中,微生物内稳态有时会因对维持现场生态稳定性至关重要的参数发生重大变化而发生破坏,从而导致社区中以前较小的组成部分的生长。这种破坏在口腔中的临床后果可能是疾病。
调节口腔内稳态的重要参数包括宿主防御的完整性(包括唾液流)和饮食的组成[13].经常食用高可发酵糖含量食物成分的受试者斑块中变形链球菌和乳酸菌的比例较大,而中性粒细胞功能受损是牙周病的危险因素。我们对特定抗菌肽在调节体内特定部位的固有菌群方面的重要性所知甚少,但它们某些活动的减少可能会增加患龋的风险(Dale -本次研讨会)。当然,抗菌肽被认为是控制口腔微生物种群的重要组成部分,尽管它们的作用是复杂的,因为它们是多功能的,不仅仅有一个抗菌作用;例如,通过将免疫反应的固有臂和适应性臂联系起来[14].
此外,确定在健康期间调节菌斑自然内稳态的因素,但当受到干扰时,会促使假定的口腔病原体富集,这可能为控制菌斑组成开辟新的途径。控制这些生态影响有助于维持菌斑生物膜的有益微生物成分和正常代谢活性,并增强控制龋齿的更传统方法。这些概念将在本文的其余部分进行探讨。
牙菌斑与疾病
已经进行了大量研究,以确定病变部位菌斑微生物区系的组成,以便尝试和识别与引起病理学直接相关的物种。由于菌斑介导的疾病发生在具有预先存在的多种常驻微生物区系的部位,因此对此类研究的数据进行解释很困难a、 与致龋性相关的性状(产酸、耐酸、胞内和胞外多糖的产生)并不局限于一个物种。对代表几个链球菌物种的菌株的特性进行比较表明,这些致龋性状的表达有相当大的重叠[15)(见下文)。菌斑等生物膜中的微生物有密切的物理接触,这可以增加相互作用的可能性,其中一些可以调节致龋细菌的致病潜力(例如,Kuramitsu和Wang -本研讨会)。同样,由致龋物种产生的酸的后果可以通过食物链的发展来改善脉内拉或由于邻近生物产生的碱基。因此,在利用特定物种的存在作为疾病的诊断或预后指标方面取得的成功有限,这并不令人惊讶。微阵列的出现,所有可能的微生物组的存在在斑块可以确定,可以使特定的微生物概要文件(或分子“签名”)被识别与龋齿或牙周病(斯特尔,这个研讨会),尽管生化活动的标记可能也是必要的。
尽管存在这些问题,但临床研究表明,龋齿与产酸和耐酸细菌比例的增加有关,特别是变形链球菌(如变形链球菌和美国sobrinus)和乳酸菌,它们能使牙釉质脱矿[16–19].这些细菌可以快速地将膳食中的糖代谢成酸,从而在当地产生低ph值。这些微生物在低ph值下生长和代谢效率最佳。在这样的条件下,它们变得更具竞争力,而大多数与牙釉质健康相关的物种对酸性环境条件非常敏感。然而,尽管变异链球菌与龋齿密切相关,但这种关联并非独一无二;龋齿可以在明显缺乏这些物种的情况下发生,而变形链球菌可以持续存在,没有可检测到的脱矿证据[20,13].确实,在这种情况下,一些产酸的非变异链球菌与疾病有牵连[18,21,22]。对大量口腔链球菌糖酵解活性的详细研究表明,一些非变形链球菌菌株(例如。美国缓和的生物变种1和美国oralis)仍能在中等低的环境pH值下将糖代谢为酸,其代谢速率可与变异链球菌的代谢速率相媲美[15].
致龋病原体的来源
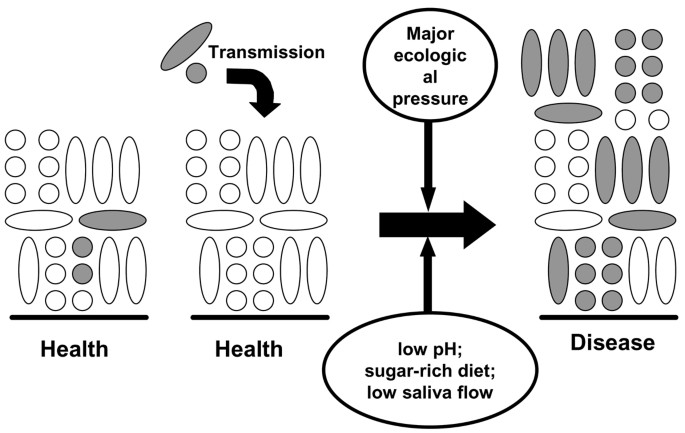
口腔病原体的起源和作用一直是争论的话题。事实上,解决这一争论对开发有效的斑块控制策略至关重要。使用传统培养技术的早期研究往往无法从健康部位恢复假定的病原体,或者当病原体存在时,它们只占微生物群的一小部分。然而,最近更灵敏的分子技术的应用,已导致在广泛的地点经常发现低水平的几种病原体(涉及龋病和牙周病)[23]细菌分型方案表明,在母亲(或其他密切护理者)和婴儿的菌斑中可以发现相同的致龋细菌菌株[24],这意味着这种细菌可能会传播。在这两种情况下(即.自然的低水平“病原体”或外源性获得的低水平“病原体”),这些物种将不得不与已经建立的微生物区系居民竞争,以达到适当程度的数量优势,从而导致疾病。如上所述,为了实现这一点,正常的体内平衡机制需要被破坏,而这只有在当地栖息地受到重大干扰时才有可能发生(图)1.).这表明,斑块介导的疾病是由于强大的选择压力的强加,病原体的微生物群落内富集,导致原有菌群的失衡。如果是这样,干扰这些驱动力可以防止病原体的选择,降低疾病的发病率。
破坏微生物稳态的因素
对一系列栖息地的研究已经提供了能够破坏微生物群落内固有稳态的因素类型的线索。一个共同特征是营养状态的显著变化,例如引入新基质或对现场进行重大化学扰动。例如,在环境中l微生物学,人们认识到,从农田冲入湖泊和池塘的氮肥会促进藻类的过度生长。藻类会消耗水中的溶解氧,导致需氧微生物、植物和昆虫的死亡(富营养化)。同样,二氧化硫和氮氧化物的大气污染可导致酸雨,对植物和树木造成损害,并造成水生生物的损失。
已知局部环境会在疾病期间改变斑块。龋齿与饮食中更经常地摄入可发酵碳水化合物有关,因此,牙菌斑更频繁地暴露于低pH值下。营养物可用性和pH值的这种环境变化对健康或疾病中占主导地位的口腔细菌基因表达的影响表明,变形链球菌等有机体能够更好地适应低pH值,他们还上调了一些基因,以防止酸胁迫。例如变形链球菌当暴露于亚致死pH值(约5.5)时,会上调一些特定的蛋白质和功能。这提高了在酸性条件下的存活率,例如在龋病损害中遇到的酸性条件[25–27].这些表型上的差异将改变菌斑中细菌的竞争力。实验室模拟研究涉及多种但已确定的口腔细菌群落,以回答有关这种变化对个体物种相对竞争力的后果和对群落稳定性的影响的具体问题。对这些研究的分析导致了一种替代假说的形成,该假说将口腔细菌与牙科疾病的作用联系起来,并确定了破坏固有菌斑菌群自然平衡的因素。
环境变化的影响——混合文化建模研究
如前所述,经常在饮食中摄入糖的人,其牙菌斑中变异链球菌和乳酸菌等致龋细菌的水平通常较高,患龋的风险也更大。在动物研究或人类流行病学调查中,永远无法确定龋齿细菌的增加是否由于糖的突然供应本身(如.因为这些细菌有更有效的糖运输系统),或者是对糖消耗后不可避免的低pH条件的反应。利用恒温器参数控制的独特优势,加上确定的混合培养接种物的可重复性,使这些连锁效应首次得以分离[28].将9种或10种(健康和疾病的代表)混合培养的恒温器接种在pH 7.0的生长培养基中,其中粘蛋白是碳水化合物的主要来源;在这种情况下,变形链球菌和乳杆菌为非竞争性,占总菌群的<1%(表1.).一旦财团稳定建立,这两个趋化器每天脉冲与发酵糖(葡萄糖)连续十天。恒化器,pH值是自动维护整个研究中性pH值(如在健康的口腔中找到)为了确定的可发酵糖的影响文化的稳定性,而在另一pH值是允许减少细菌代谢为每个脉冲(6小时后发生在活的有机体内);然后在下一次脉冲前18小时将pH恢复为中性[28].在恒定pH 7.0条件下,连续10天每日葡萄糖脉冲对微生物群落的平衡影响很小或没有影响变形链球菌和喂食约占总菌群的1%1.).然而,相比之下,当每次脉冲后允许pH值改变时,龋齿(和酸耐受性)物种的选择是渐进的,而与牙齿健康相关的细菌则是牺牲的。在最后一次葡萄糖脉冲后,群落以与龋齿有关的物种为主(变形链球菌和喂食约占微生物区系的55%)[28]重复该研究时,但在独立实验中,每次葡萄糖脉冲后pH值下降限制在pH值5.5、5.0或4.5[29],观察到以牺牲健康物种为代价的类似龋齿物种富集,但它们的上升与pH下降的程度成正比(表)1.).总的来说,这些研究明确地表明,是糖代谢产生的低pH值,而不是糖的可用性,导致了牙菌斑中的微生物稳态的破坏。这一发现对龋齿的控制和预防具有重要意义;数据表明,如果降低糖代谢后pH值的变化,就可以防止龋齿细菌的选择(见下文)。
目前解释牙菌斑细菌在龋齿病因中作用的假说
关于菌斑细菌在龋病和牙周病的病因学中的作用,有两种主要的思想流派。“特定菌斑假说”提出,在组成菌斑菌群的各种生物中,只有少数物种积极参与疾病[30.].这项建议的重点是通过针对有限数量的生物体采取有针对性的预防措施和治疗来控制疾病。相反,“非特异性斑块假说”认为疾病是总斑块菌群整体活动的结果[31]在某些方面,关于这些假设相对优点的争论可能是关于语义的,因为斑块介导的疾病本质上是混合培养(多微生物)感染,但其中只有有限的(可能是特定的!)物种数量能够占优势。
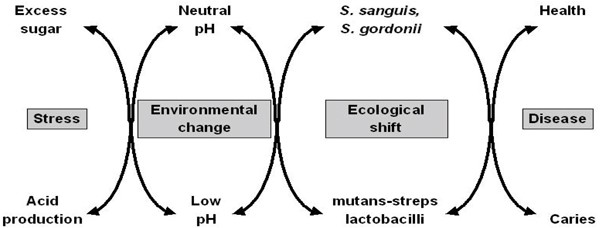
最近,提出了另一种假说(“生态斑块假说”),调和了前两种假说的关键要素[32].上述混合培养研究和其他工作的数据提供了一个论点,即斑块介导的疾病被认为是由这些“口腔病原体”的微生物群落的富集导致的原住菌群失衡的结果。潜在的致龋细菌可能自然存在于牙菌斑中,但这些微生物仅在中性pH下竞争弱,并且在整个菌斑群落中占很小的比例。在这种情况下,使用传统饮食,这些潜在的致龋细菌的水平在临床上是不显著的,去矿化和再矿化的过程处于平衡状态。如果可发酵碳水化合物摄入的频率增加,菌斑就会在牙釉质脱矿的关键pH值(大约pH 5.5)以下停留更长时间。这对菌斑微生物生态的影响是双重的。低pH的条件有利于耐酸(和产酸)细菌的增殖(特别是变形链球菌和乳酸杆菌),同时将平衡向脱矿倾斜(图)2.).菌斑中的变形链球菌和乳酸菌等细菌数量越多,就会以更快的速度产生更多的酸,从而进一步增强脱矿作用。其他细菌也可以在类似的条件下制造酸,但速度较慢[15]。这些细菌可能导致某些脱钙的初始阶段,或在没有其他细菌的情况下导致病变(更明显)更易受感染宿主中的致龋物种。如果最初不存在酸中毒物种,则低pH值的重复条件加上竞争生物体的抑制可能会增加变形链球菌或乳酸杆菌成功定植的可能性。这一事件序列将解释缺乏总特异性在龋病的微生物病原学中具有重要意义,并解释了许多临床研究中观察到的细菌演替模式。
这一假设的主要特征是:(a)“致病”细菌的选择与环境的变化直接耦合(图)2.),以及(b)疾病不需要有特定的病因;任何具有相关特征的物种都可能导致这种疾病的发生。因此,变异链球菌是最能适应龋齿环境(高糖/低pH)的生物之一,但这些特征并非这些细菌所独有。其他种类的菌株,如成员美国缓和的-组,也有一些共同的这些属性,因此将有助于牙釉质脱矿[15,21,22].生态斑块假说的一个关键因素是,疾病不仅可以通过直接瞄准假定的病原体来预防,如.通过抗菌或抗粘附策略,但也通过干扰导致其富集的选择压力[32].
在龋齿中,糖/低pH值或唾液流的减少似乎是破坏微生物稳态的主要机制。与通过生态斑块假设原则预防疾病相一致的策略包括:
(a)抑制菌斑酸生成;如氟化物不仅能改善牙釉质的化学性质,还能抑制几种关键酶,尤其是那些参与糖酵解和维持细胞内pH值的酶[33].氟化物可以降低菌斑生物膜中糖代谢后pH值的下降,这样做,防止建立有利于耐酸蛀牙物种生长的条件[34].
(b) 避免食用含有可发酵糖的食品和饮料的主食和/或食用含有不可发酵糖替代品(如阿斯巴甜或多元醇)的食品/饮料,从而减少牙菌斑中反复出现的低pH值情况。
(c)刺激主餐后唾液流动;如.无糖口香糖。唾液会引入宿主反应的成分,增加缓冲能力,清除可发酵的底物,促进再矿化,并更快地将斑块的pH值恢复到静息水平。
结论
要更全面地了解微生物在龋齿等牙齿疾病中的作用,关键可能取决于范式的转变,即从传统医学感染研究演变而来的概念,改用简单而具体的(如.单一物种)病原学到生态学原理的欣赏。斑块介导的疾病在某一部位的发展可能被视为体内平衡机制的破坏,而这种机制通常在宿主口腔菌群和宿主之间维持有益的关系。当评估治疗方案时,口腔生态的评价将使开明的临床医生采取更全面的方法,并考虑患者的营养、生理、宿主防御和一般健康状况,因为这些将影响口腔微生物群落的平衡和活动。除非发现和纠正导致内稳态崩溃的原因,否则未来的疾病发作将会发生。例如,许多药物的副作用是唾液流量减少。这将有害地影响糖的清除和缓冲能力,从而有利于酸耐受性和潜在的龋齿细菌的生长。确定这些关键控制点可导致根据个别患者的需要选择适当的龋齿预防策略。通过这种方式,临床医生不仅治疗龋齿过程的最终结果,而且还试图识别和干预因素,如果不加以改变,将不可避免地导致更多的疾病。
参考文献
- 1.
牙科生物膜:困难的治疗靶点。牙周病杂志,2002,28:12-55。
- 2.
作为微生物生物膜的牙菌斑。中国生物医学工程学报,2004,38:204-211。
- 3.
致病协同作用:口腔内的混合感染。范列文虎克,1984,50:789-798。
- 4.
Gilbert P,Maira Litran T,McBain AJ,Rickard AH,Whyte FW:微生物生物膜群落的生理学和集体顽抗性.微生物生理学杂志,2002,46:203-255。
- 5.
口腔菌群在健康中的作用。微生物生态卫生,2000,12:130-137。
- 6.
klenbrander PE, Andersen RN, Kazmerak KM, Palmer RJ:口腔生物膜的共聚集和共粘附。生物膜的群落结构与合作。编辑:Allison DG, Gilbert P, lapin - scott HM, Wilson M. 2000,剑桥,剑桥大学出版社,一般微生物学会研讨会59,65-85。
- 7.
匆忙DL, Ofek I, Courtney HS, Doyle RJ:多种粘连剂链球菌《感染免疫》,1992,60:2147-2152。
- 8.
张颖,雷勇,张玉华,张玉华链球菌gordoniiSspAB改变多种粘连蛋白基因的表达。中华结核和呼吸杂志,2003,23(4):531 - 534。
- 9.
韦德华:口腔生物膜中的不可培养细菌。牙菌斑再现。健康和疾病中的口腔生物膜。编辑:Newman HN, Wilson M. 1999, Cardiff: BioLine, 313-322。
- 10.
Marsh PD,Featherstone A,McKee AS,Hallsworth AS,Robinson C,Weatherell JA,Newman HN,Pitter AF:学龄儿童近面早期龋齿的微生物学研究。Dent Res.1989,68:1151-1154。
- 11
Kolenbrander PE, Andersen RN, Blehert DS, Egland PG, Foster JS, Palmer RJ:口腔细菌间的交流。微生物微生物学杂志,2002,26:486-505。
- 12
链球菌生物膜形成的群体感应。微生物学进展。2005,13:3-6。
- 13
宿主防御和微生物稳态:微生物相互作用的作用。《中国科学院院刊》1989年第4期。
- 14.
《口腔和呼吸道防御中的抗菌肽》,《分子免疫学》,2003,40:431-443。
- 15.
desoet JJ, Nyvad B, Kilian M:通过口服产生菌株相关的酸链球菌.中国生物医学工程学报,2000,34:486-490。
- 16
Loesche WJ:变形链球菌在人类的蛀牙中。微生物学修订版,50:353-380。
- 17.
鲍登GH:人类根面龋的微生物学。中国海洋大学学报(自然科学版),1998,16(4):514 - 514。
- 18.
牙菌斑和龋齿的微生物学方面。登特·克林顿,1999,43:599-614。
- 19.
Becker MR, Paster BJ, Leys EJ, Moeschberger ML, Kenyon SG, Galvin JL, Boches SK, Dewhirst FE, Griffen AL:儿童龋相关细菌种类的分子分析。临床微生物学杂志,2002,40:1001-1009。
- 20.
Bowden GH, Hardie JM, McKee AS, Marsh PD, Fillery ED, Slack GL: 13-14岁儿童上第一前磨牙远端表面龋齿病变相关的微生物区系。龋齿的微生物方面。编辑:Stiles HM, Loesche WJ, O'Brien TC。1976,华盛顿特区:情报检索公司,1:233-241。
- 21.
sanone C, van Houte J, Joshipura K, Kent R, Margolis HC:变形链球菌和非变形链球菌在低pH条件下发生酸生成与牙釉质和根表面龋齿的关联。中国海洋大学学报(自然科学版),2003,21(4):513 -516。
- 22.
Brailsford SR, Shah B, Simins D, Gilbert S, Clark D, Ines I, Adama SE, Allison C, Beighton D:根龋损伤的主要酸性菌群。王志强,王志强。
- 23
Tanner AC, Milgrom PM, Kent R, Mokeem SA, Page RC, Riedy CA, Weinstein P, Bruss J:幼儿牙齿和舌头样本中的微生物群。王志强,王志强。
- 24
Tanner AC, Milgrom PM, Kent R, Mokeem SA, Page RC, Liao SI, Riedy CA, Bruss JB:一项基于人群的研究中学龄前儿童与其照顾者口腔微生物群的相似性。口腔微生物学杂志。2002,17:379-387。
- 25
Welin J, Wilkins JC, Beighton D, Wrzesinski K, Fey SJ, Mose-Larsen P, Hamilton IR, Svensater G:酸休克对生物膜细胞蛋白表达的影响变形链球菌.微生物微生物学杂志。2003,27(4):487 - 493。
- 26.
应激反应蛋白在大肠杆菌中的表达上调变形链球菌耐酸期间。微生物学。2004,150:1339-1351。
- 27.
陈志强,陈志强。酸胁迫对生物膜细胞生理特性的影响变形链球菌.微生物学杂志,2004,30(4):437 - 442。
- 28
碳水化合物脉冲和pH值对口腔微生物群落中种群变化的影响在体外.陈志强,陈志强,陈志强,等。
- 29.
Bradshaw DJ,Marsh PD:pH驱动的口腔微生物群落破坏分析在体外.中国生物医学工程学报,1998,32:456-462。
- 30.
牙菌斑感染的化疗。中国口腔医学杂志,1996,13(4):514 - 514。
- 31.
《炎症性牙周病微生物病原学的非特异性理论》。临床牙周病杂志,1996,13:905-911。
- 32.
马什PD:牙病是生态灾难的例子吗?微生物学学报,2003,29(4):429 - 434。
- 33.
氟和有机弱酸对微生物生理的调节作用。微生物学进展,26:493-510。
- 34.
Bradshaw DJ, Marsh PD, Hodgson RJ, Visser JM:葡萄糖和氟对体内竞争和代谢的影响在体外牙科细菌群落和生物膜。中国生物医学工程学报,2002,36:81-86。
作者信息
从属关系
相应的作者
额外的信息
竞争利益
作者声明他们没有相互竞争的利益。
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介中不受限制地使用、分发和复制,前提是原作被正确引用。
关于这篇文章
引用这篇文章
作为生物膜和微生物群落的牙菌斑对健康和疾病的影响。BMC口腔健康6.S14(2006年)。https://doi.org/10.1186/1472-6831-6-S1-S14
关键词
- 乳酸菌
- 牙周疾病
- 龋齿
- 牙菌斑
- 变形链球菌