摘要
背景
本研究旨在通过研究菌斑微生物群与围产期艾滋病毒感染和暴露之间的关系,更好地了解感染艾滋病毒的尼日利亚学龄儿童龋齿风险增加的机制。我们还试图调查围产期艾滋病毒感染和暴露如何影响牙齿特异性微生物在龋齿疾病进展中的作用。
方法
本研究的参与者是2019年5月至11月从尼日利亚贝宁大学教学医院(UBTH)招募的4至11岁儿童。总的来说,568名儿童被纳入三个组:189名hiv感染(HI), 189名hiv暴露但未感染(HEU)和190名hiv暴露但未感染(HUU)作为对照,分别为2.99%和4.90%的流失率在就诊1和就诊3。数据通过标准化问卷获得。采集血样进行HIV、HBV、HCV筛查;CD4、CD8和全血计数分析;以及为未来研究储存的血浆样本;在不同的研究访问中无菌采集了受试者的口腔样本,包括唾液、口腔拭子、口咽拭子、舌拭子和牙菌斑。
结论
这项研究的结果将提供关于HIV暴露、感染和治疗如何影响儿童口腔微生物群和龋齿易感性的关键信息。通过确定口腔微生物群落分类学结构和基因表达的影响,我们将阐明可能产生龋齿易感性的机制。作为未来的计划,呼吸道感染、免疫和炎症标志物与围产期HIV感染和暴露的龋齿之间的关系将被研究。
背景
越来越多的证据表明,感染艾滋病毒导致龋齿的负担、严重程度和风险更高[1,2,3.,4,5,6,7,8,9,10].然而,目前还没有足够的数据来解释微生物水平上这种更高风险的机制。而一些研究[11,12,13,14,15,16,17]报告了艾滋病毒感染儿童的语言和唾液样本与未感染个体的细菌群落的显著差异,其他研究没有观察到艾滋病毒感染儿童与未感染儿童之间的显著差异[11,12,13,15,18,19,20.,21,22].
在撒哈拉以南非洲的发展中国家,艾滋病毒感染负担特别高。尼日利亚是全球艾滋病毒感染率第二高的国家,其中有190万人感染艾滋病毒,其中35%是儿童,每年约有20万儿童由携带艾滋病毒的母亲所生[23].高活性抗逆转录病毒疗法(HAART)的普及和广泛使用已导致感染围产期获得性艾滋病毒的儿童人数大大减少。然而,许多接触过艾滋病毒但未被感染的儿童被认为有更多的机会发展为早期感染和增加免疫系统损伤。儿童早期龋齿(ECC)在发展中国家的发病率也很高,并可能导致患龋齿儿童的生活质量下降。因此,有必要更好地了解HIV状态对与ECC相关的口腔细菌组和真菌组的影响。此外,随着撒哈拉以南非洲暴露于艾滋病毒但未受感染的儿童人数越来越多,研究[24,25,26,27,28研究表明,婴儿早期感染和死亡的风险增加,生长受损,以及患龋齿的风险更高(尽管不显著),这表明围产期接触艾滋病毒与不成熟的免疫反应有关。此外,先前对这一人群的研究发现,高浓缩铀儿童,像HI儿童一样,比未暴露的儿童具有更低的CD4值[25].
为了前瞻性评估艾滋病毒对尼日利亚儿童口腔微生物群和龋齿风险的影响,我们于2019年启动了尼日利亚幼儿龋齿及其与口腔微生物群和艾滋病毒的关系(domhain研究)研究。DOMHaIN研究是一项正在进行的针对尼日利亚幼儿的前瞻性队列研究,旨在通过使用下一代测序(NGS)技术和牙齿特异性采样,为尼日利亚4至11岁的hiv感染(HI)、hiv暴露但未感染(HEU)和hiv暴露但未感染(HUU)儿童龋齿不同阶段的牙菌斑群落提供详细的分类和功能特征。本研究旨在研究斑块微生物组与围产期HIV感染和暴露之间的关系,并研究围产期HIV感染和暴露如何影响微生物组在龋齿疾病进展中的作用。我们的核心假设是,艾滋病毒感染和治疗对牙齿微生物群产生不利影响,将社区转变为一种使儿童易患龋齿的状态。来自这一队列的数据将提高我们对口腔微生物组与艾滋病毒感染儿童的健康和疾病结果之间复杂关系的理解,并将有助于越来越多侧重于了解人类微生物组的文献。在这里,我们介绍了在撒哈拉以南非洲进行这项独特研究的方法和程序。
方法/设计
研究设计
DOMHaIN是一项前瞻性队列研究,研究对象为2019年5月至11月从贝宁大学教学医院(UBTH)招募的4至11岁儿童。三组儿童参加了这项研究进行比较;艾滋病毒感染者、暴露但未感染艾滋病毒的人以及未暴露但未感染艾滋病毒的人作为对照。
该研究正在尼日利亚南部埃多州的一家领先的多专科三级医疗保健服务提供商UBTH实施。该地区15-49岁成年人中艾滋病毒感染率为3.1%,为全国最高,其中32%为孕妇[29].作为一个拥有860张床位的三级转诊医院,UBTH被广泛认为是一个卓越的中心,并出色而有效地成为Edo、Delta、Kogi和Ondo州(主要是其集水区,有时更远)的各种疾病的专家管理的最后一个港口。
道德的考虑
马里兰大学巴尔的摩分校(HP-00084081)、罗格斯州立大学新泽西分校(Pro2019002047)和贝宁大学教学医院(ADM/E22/A/VOL)的机构审查委员会。尼日利亚VII/14713)批准了这项研究。研究人员会用英语和洋泾浜英语向父母/监护人或照顾者口头解释所有的研究活动,以及自愿参与的风险和好处。问问题是为了确认理解。在招募前获得书面知情同意。
招聘
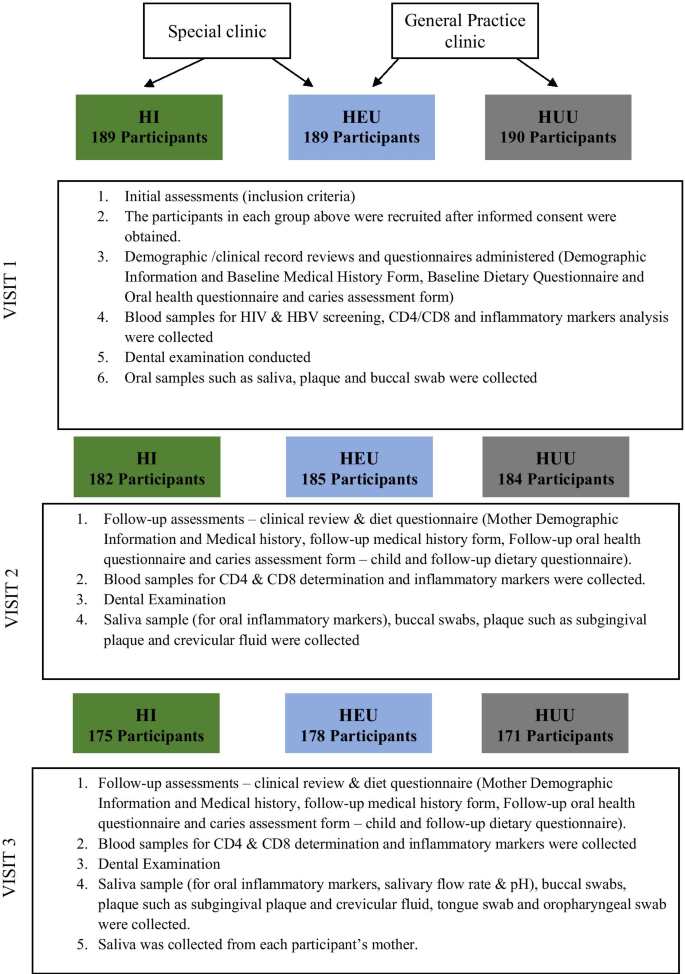
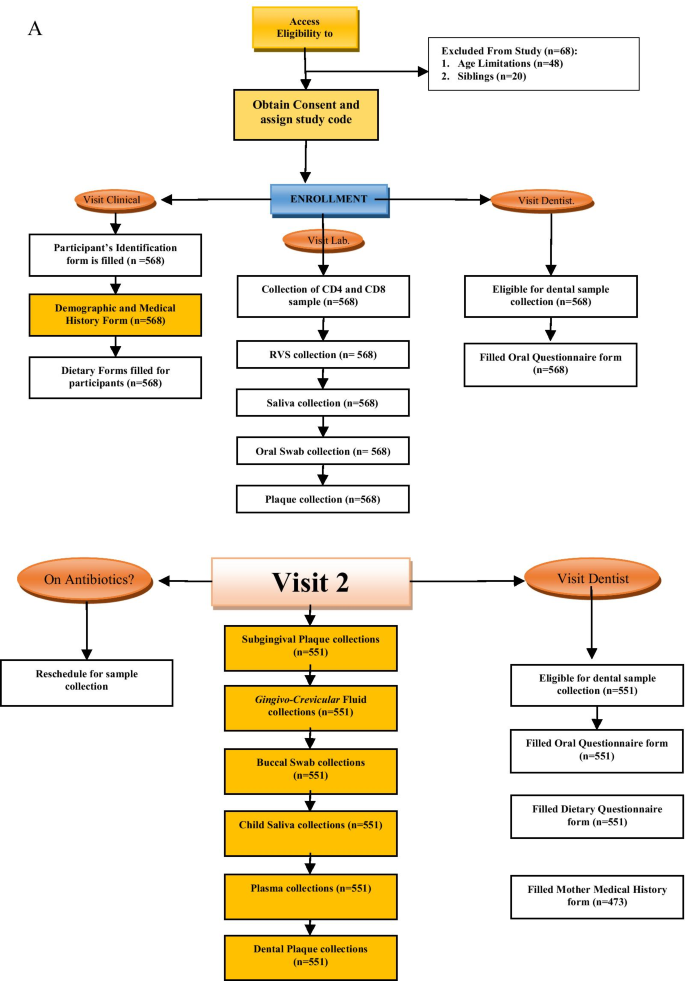
DOMHaIN研究是一项前瞻性单中心研究,招募过程长达7个月,由训练有素的医疗专业人员接触到4-11岁儿童的父母,这些儿童在HI和HEU的儿科艾滋病特殊治疗诊所和HUU的儿科门诊接受治疗。在研究开始之前,研究团队在为期3天的综合培训讲习班中会见了社区代表、卫生中心工作人员和领导。根据我们过去在这个地点的经验,这个策略确保了持续的热情和合作,并鼓励参与研究研究。研究开始后,我们的首席研究员(pi)和现场领导组织了两周一次的会议,以解决招聘方面的任何挑战。社区卫生工作人员将被告知这项研究,并提供了研究目的和研究程序的简单说明。每一位愿意参与这项研究的监护人和家长,都要在一对一的环境下,通过书面和口头的研究描述,然后签署同意书。训练有素的保健专业人员在一个星期的五个工作日内前往上述两个诊所,与合格参与者的母亲接触。共招募了568名参与者(包括兄弟姐妹),所有人都完成了基线问卷。数字1突出显示与会者注册过程。总的来说,研究中招募的568名儿童包括189名HI、189名HEU和190名HUU个体(图。1).参与研究的儿童接受了艾滋病毒检测,以准确地对他们进行分类,并要求按照研究计划进行跟踪。
跟进
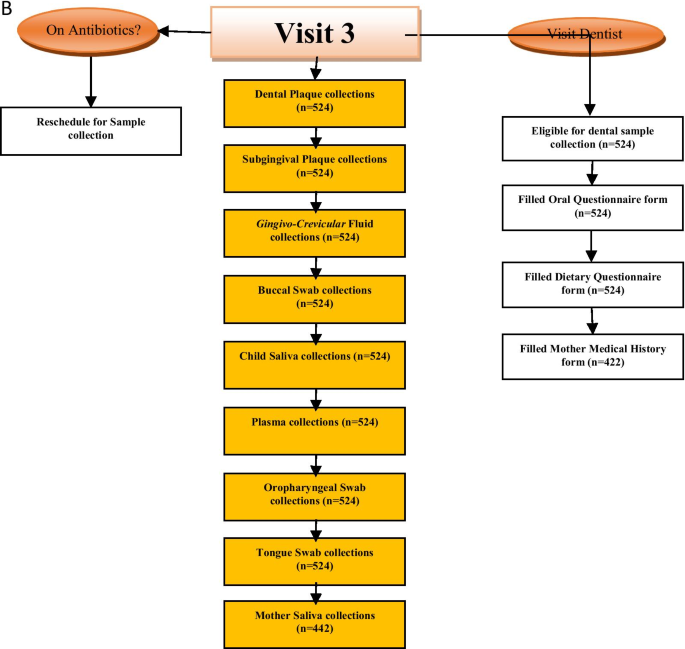
本研究的随访分为两期:基线后6个月(V2期)和基线后12个月(V3期)。每次随访均采用结构完善的问卷收集数据,每次随访均进行样本收集(图;2a, B)。研究参与者的母亲/照顾者在访问日前1个月、2周、1周、2天以及访问当天上午通过短信服务、语音电话、第三方联系方式和家访联系。对于有期中考试等学术活动的参加者,考试安排在参观参考期内更方便的日子进行。除自愿退出研究、迁出研究地理位置、死亡或无法通过电话/家访联系到上一次访问的参与者外,所有参与者都被认为符合随访的条件。图中概述了每次访问收集的样本和不同的调查问卷。1.第2次访问和第3次访问的人员流失率分别为3%和4.9%,这表明尽管COVID-19大流行,参与者仍然成功地保留了下来。招聘和保留策略包括文化敏感,经验丰富和多样化的研究团队,良好的沟通协议和激励措施的使用。本研究采用的其他策略以满足研究地点和参与者的需求,包括:与护理点医生合作,响应临床环境;并解决参与者的健康素养和父母/或照顾者的教育水平。研究中所有参与者的预定随访时间(第2和第3次)为2019年11月至2020年12月。
数据收集及措施
这项研究的目的是使用所有在特殊治疗诊所接受治疗的合格年龄范围内的艾滋病毒感染儿童的数据。因此,该样本代表了研究开始时该年龄组的hiv阳性病例的接近完整的人群。此外,这项研究计划是第一个纵向研究,使用以下措施比较尼日利亚HI、HEU和HUU儿童的口腔健康状况和结果。
艾滋病毒状况确定
为了准确地识别群体,研究人员在审查孕妇和儿童医疗记录的基础上确定了艾滋病毒感染或接触情况,并在入学时对儿童参与者进行了艾滋病毒确认测试。
根据世卫组织和尼日利亚卫生部关于婴儿早期检测艾滋病毒的指南,在产后6周和非母乳喂养的婴儿4个月或母乳喂养停止后2个月对所有高纯度婴儿进行了艾滋病毒DNA PCR检测[30.,31]使用COBAS®AmpliPrep/COBAS®TaqMan®HIV-1定性检测2.0版本(TaqMan®HIV-1质量检测2.0版本),一种双目标总核酸实时PCR检测方法。
根据尼日利亚卫生部的指导方针,UBTH的围产期暴露或受感染的儿童开始接受抗逆转录病毒治疗,该指导方针还建议对需要治疗疾病的孕妇进行HAART治疗,或在停止母乳喂养一周之前采用三种方案B预防方案,并建议婴儿从出生到6周期间使用奈韦拉平,并告知开斋期的样本采集时间(干血点)。
以前根据世卫组织指南使用快速抗体测试从产后18个月收集的血液样本确定了高浓缩铀儿童的艾滋病毒状况,尼日利亚卫生部批准了艾滋病毒测试算法[30.,31].在DOMHaIN的研究中,从健康婴儿和儿童儿科诊所招募了高性腺病毒和高性腺病毒的儿童,并通过快速抗体测试确认了他们的艾滋病毒状况。
研究访问和数据收集
分别在基线、6个月和12个月后对参与者进行评估。在所有访视中,通过一份结构良好的问卷获得病史和牙科病史、人口统计数据、基线饮食信息以及口腔健康/龋齿评估。流式细胞术获得CD4 + t细胞计数、百分比值及CD8 + t细胞计数。护理人员使用标准化问卷对儿童的社会人口学特征、喂养和口腔卫生习惯进行访谈。母婴病历、问卷、口腔检查用R v3.6.0 (http://www.R-project.org),分析可能导致尼日利亚HI、HEU和HU儿童患龋的不同因素和可能性。从这些访谈中获得病史,并通过检查图表确认或解决。根据CDC 2014年对HIV感染阶段的病例定义,评估了CD4 + t细胞计数和百分比。出生体重、当前体重、身高和用药记录均来自医疗记录。还评估了母亲的教育和就业状况。同意参与这项研究的参与者进行了三次访问;基线、6个月(V2)和12个月(V3)。图中详细列出了每次就诊的组成部分。2a、b。
在每次研究访问中使用标准化的问卷来记录一般的医疗信息,包括药物和共病史,一般的身体检查结果和人体测量评估。通过自我报告问卷评估人口统计信息和个人特征。问卷收集的数据包括人口因素、医疗和口腔健康史、牙齿卫生、饮食摄入(通过食物频率问卷)和药物。
人体测量
所有的措施都是由经过培训和认证的工作人员按照以下所述的标准化规程进行的。身高和体重由一名训练有素的技术人员用软米制卷尺和体重秤测量。在测量体重的过程中,研究人员要求并观察孩子们不要身体前倾或抱着任何形式的支撑物;这样做是为了精确测量[32].此外,称重秤定期由一个已知的重量单位检查,以确保其准确性。在测量高度时,孩子们被要求不穿鞋站立,脚跟并拢,站直,直视与地面平行的法兰克福飞机。测量是在头顶最高点的水平支撑下完成的。
喂养方法/膳食评估
根据儿童家长或照顾者在各自访问时填写的基线和后续膳食问卷,收集儿童的喂养做法信息,如表所示1.问卷包含母乳喂养的信息,包括开始和停止母乳喂养的年龄和特定的液体食物摄入,包括此类访问日期前24小时内的频率和次数的详细信息。在所有适用的就诊时收集关于开始接触各种固体食物和饮料的年龄的信息(表1).
牙科检查及评估
牙科检查是由有资格、受过训练及校正的牙医按照世界卫生组织评估蛀牙的准则进行的。[33]及国际龋病检测及评估- icdas评分[34他们忽视了孩子们的地位。检查是在牙科椅上进行的,带有牙科镜、探针和人造光。牙齿分类为无龋齿或龋齿影响病变的位置在珐琅质或牙质使用FDI命名。
口试
口腔检查包括头部、颈部的检查,口腔内硬、软组织的评估一致一致。体格检查包括可能的病变、面部不对称和肿胀。头颈部触诊以确定可能的淋巴结病变、肿块和压痛。检查颞下颌关节的压痛,评估任何有限的开放,偏差或任何不对称。根据世界卫生组织评估龋病的标准,进行口腔内检查,以确定是否有龋病及其严重程度[33]及国际龋病检测及评估- icdas评分[34].此外,口腔卫生状况也被确定。
由Greene和Vermillion提出的“口腔卫生指数(简化)-OHI-S”[35,36]用于评估口腔卫生状况。OHI-S包括碎屑和牙石指数,这是通过在索引齿表面发现的6个数值来确定碎屑或牙石的数量得到的。恒齿和落叶齿分别为11、16、26、31、36和46,以及51、55、65、71、75、85 [37].正如之前报道的那样,碎屑和微积分分数的总和除以每个研究对象的表面分数[37].口腔卫生分为良好(0 ~ 1.2分)、一般(1.3 ~ 3.0分)、不良(> 3.1分)。
龋齿的评估
使用dmft/ dmft对主牙/恒牙(龋齿、因龋齿而缺牙和补牙)进行龋病患病率和严重程度的定义。x线片没有被用来确定龋齿或确定牙髓的影响。根据国际龋齿检测与评估- icdas评分[34]及世界卫生组织评估蛀牙的准则[33].
为了解释同一个体微生物群落随时间的变化,对儿童进行了为期12个月的随访,并分别在基线(V1)、6个月(V2)和12个月(V3)取样。我们排除了以下儿童:(i)在过去三个月内接受过抗生素/抗真菌治疗,以及(ii)接受过牙齿矫正器具。根据牙齿的起源情况,牙菌斑样本的特征如下:(i)牙齿表面无龋病(PF;ICDAS = 0), (ii)牙齿表面有活性的牙釉质龋损(PE;ICDAS = 1-3),以及(iii)具有活性牙本质龋损的牙齿表面(PD;Icdas≥4)[38].其次,根据龋齿状况进行分组:(i)无龋齿(CF),无龋齿临床或报告的龋齿经验证据[龋齿、缺牙和补牙(DMFT) = 0];(ii)只有牙釉质病变的龋[(CAE);DT = 0;MFT≥0);和(iii)龋齿活跃,至少有两个空洞的、未修复的牙本质龋齿病变[(CA);Dt≥2,mft≥0]。然后,考虑到孩子的龋齿状况,每个菌斑样本将被放在以下六个类别之一:(1)无龋齿儿童;样本取自无龋牙面(CF-PF),(2)釉质病变活跃的儿童;样本取自无龋牙面(CAE-PF),(3)釉质病变活跃的儿童; sample obtained from an active, enamel carious lesion (CAE-PE), (4) child with at least two cavitated, unrestored dentin carious lesions; sample obtained from a caries free tooth surface (CA-PF), (5) child with at least two cavitated, unrestored dentin carious lesions; sample obtained from an active, enamel carious lesion (CA-PE), and (6) child with at least two cavitated, unrestored dentin carious lesions; sample obtained from an active dentin carious lesion (CA-PD). Lastly, children were categorized according to their HIV status: (1) HI children receiving HAART (2) HIV exposed but uninfected children (HEU), and unexposed and uninfected (HUU) children. For any child, it was possible to collect up to three different categories of plaque sample (based on the condition of the tooth) (PF, PE, PD). Due to differences in caries status among children, we estimated an average of two plaque samples per child will be collected. This equates to 200 plaque samples per HIV status with 50 for each of the six overall plaque categories. Plaque samples were stored in RNA晚些时候(Qiagen)−80°C。每年两次,从第1年到第3年,样本被冷冻在干冰上直接从尼日利亚的UBTH/IHVN运到PI在克莱姆森(理查兹)或罗格斯(科克)的实验室。
样品收集
无菌采集每个参与者的口腔样本,如唾液、口腔拭子、龈龈液、口咽拭子、龈上菌斑、龈下菌斑和舌拭子样本,适当标记并保存在−80°C(菌斑和唾液)或−20°C(口腔拭子和舌拭子),用于高通量下一代测序,以提供口腔微生物组的详细分类和功能表征。
采集前准备-所有参与者在样本采集前2小时内禁食,12小时内保持口腔卫生(刷牙或使用牙线)。使用无菌格蕾西刮匙®在选定的下颌前牙的舌侧和选定的上颌后牙的颊侧收集龈上斑块。将菌斑刮片放入无菌、预先标记的2ml低温小瓶中,随后放入500 ml RNA,取样后立即冰封,收集后2小时内运送至实验室,在−80°C的9 × 9层压硬纸板箱中储存。在第一磨牙近颊部、牙周袋顶部或龈缝处采集龈下菌斑标本,冠状面微压取菌斑。但是,如果有病变的牙齿或粘膜,将从该部位收集龈下菌斑并记录。使用无菌格蕾西刮匙®收集龈下菌斑,然后立即放入无菌锥形管中。管子被密封起来,贴上电脑生成的标签。采集后的样品通过冰储存来保持凉爽。样品储存于−80℃,9 × 9层压纸板储存。样品在上午(中午前)采集,采样后立即置冰,2小时内运至实验室,−80℃保存,然后进行进一步处理[39,40].基于牙齿健康,研究人员从每个参与者的某一部位(每颗牙齿)以特定的方式获得了多达三种菌斑样本。来自不同牙齿的个体样本未合并(PF =无龋牙面(ICDAS = 0), PE =有活性牙釉质龋损的牙齿面(ICDAS = 1-3);PD =牙齿表面有活泼的牙本质龋损(ICDAS≥4)。
龈沟液(GCF)样品分别用Mynol®绝对纸尖和peripaper strip®进行采集。参与者被要求张大嘴巴,并用木铲将舌头悬空。将无菌纸尖和周纸条用消毒过的大学用镊子取下,放在磨牙和门牙表面吸收液体约1分钟,然后转移到预先标记好的2ml冷冻管中。对于龈上和龈下菌斑的采集,采集后用冰运输到实验室,然后在−80°C保存在9 × 9层压硬纸板箱中。
使用Isohelix Sk-2®拭子棒采集口腔拭子。拭子棒在口腔颊壁摩擦约50次,持续30秒,然后放入预先标记的5ml含有Isohelix®dric -胶囊的冷冻瓶中,置于冰上。采集完成后,将样品冰运至实验室,贴好标签,用7 × 7层压硬纸板收纳箱at-20保存0C用于高通量下一代测序,提供口腔微生物组的详细分类和基因表达特征。
收集未受刺激的儿童唾液样本;参与者被要求抬起头躺在考试沙发上。在木铲的帮助下,让唾液在口腔中聚集约5分钟,然后用无菌塑料移液器将唾液吸入两个单独的冰上标有标签的2ml低温小瓶中。采集后的样品用冰块运输到实验室,并做好标签,保存在- 80℃的9 × 9层压硬纸板储存箱中。还从母亲那里收集了未受刺激的唾液样本(如果有的话);研究人员给这些成年参与者一个50毫升的宽口猎鹰管,并要求参与者向猎鹰管流口水,产生5毫升唾液。样品被分配到两个2毫升预先标记的冰冻小瓶中。采集后的样品用冰块运输到实验室,并做好标签,保存在- 80℃的9 × 9层压硬纸板储存箱中。
舌拭子也使用Isohelix Sk-2®拭子试剂盒收集,借助木制铲悬挂上下牙齿。与口腔拭子相似,拭子棒在舌头表面摩擦50次,持续30秒,然后将其放入预先标记好的带有干燥胶囊的5ml低温小瓶中,并置于冰上。从收集点到实验室保持冷链,在实验室中处理并在−20°C的7 × 7层压纸板储存盒中存储。
口咽拭子的采集由一名训练有素的牙医放置在参与者的身旁。参与者的头被轻微地向后倾斜,并被要求把嘴张得足够大,露出扁桃体和喉咙后部。用降舌器使舌头远离喉咙后部,暴露扁桃体上的红白斑点。用口咽拭子擦拭所确定的区域,但不接触舌头和喉咙。将拭子的头部折断,放入预先标记好的5ml冷冻小瓶中,小瓶中含有1ml RNAlater。采集后的样品用冰块运输到实验室,并做好标签,保存在- 80℃的7 × 7层压硬纸板箱中。注意:所有收集的样本,从收集地点到处理和储存样本的实验室,均维持冷链[40].
根据国际航空运输协会(IATA)的惯例标准,将样品从采集地点运往美国克莱姆森大学,大约每六个月安排一次。所有拭子样品采用干冰(固化碳(IV)氧化物)装在7 × 7层压纸板收纳箱中,菌斑和唾液样品采用9 × 9层压纸板收纳箱装在SAF-T吸收剂和透明生物危险品袋中,由国际快递公司提供服务。
pH值测定
在MColourpHast™(pH指示条(无出血)pH值0-14通用指示剂)的帮助下测定每个参与者的唾液pH值。按照上述方法采集唾液,将pH值为0-14的四色色差深条浸入样品中,用计时器计时2min。在2分钟结束时,将pH值测试条上的颜色变化与测试条包装上的色度计进行匹配,范围从0到14,并记录相应的颜色匹配值。
唾液流速测定
参与者被要求躺在牙科椅上。用木铲悬挂上下牙齿,让未受刺激的唾液在口腔中聚集约5分钟,然后用无菌塑料吸管将唾液吸进刻度为15毫升的猎鹰管中,测量并记录唾液的体积。记录值除以唾液产生时间(一般为5分钟);记录的值为唾液流速。
血的措施
采用真空负压采血的方法,从每个参与者的静脉穿刺取全血10ml,分两份5ml,分别装入EDTA容器中,其中一份用于逆转录病毒、HBV和HCV筛查,血浆用于未来的IL-10、IL-2、IL-6和c反应蛋白检测,另一份用于CD4和CD8流式细胞仪分析。
用血清学HIV检测试剂盒检测HIV状态
在这项研究中,根据尼日利亚联邦卫生部艾滋病毒护理和治疗指南确定了围产期接触艾滋病毒儿童的艾滋病毒状况。对非母乳喂养母亲所生的婴儿在4个月时和母乳喂养母亲所生的婴儿在停止母乳喂养两个月后进行早期婴儿诊断,结果从患者的文件夹中检索。使用国家算法的血清学试剂盒对研究中暴露-未感染(HEU)和未暴露-未感染(HUU)的儿童进行筛查,以重申他们的状态,例如,作为第一线试剂盒的确定试剂盒,Unigold试剂盒确认来自确定和Statpak的阳性结果,作为前一个试剂盒(确定和Unigold)的所有不确定结果的决一局。41(参见补充信息-附加文件1).
流式细胞术检测CD4和CD8细胞计数
试验原理。流式细胞术是一种将细胞或微颗粒在悬浮液中进行分化,根据细胞大小和内部结构进行计数的方法。在Sysmex/Partec Cyflow Counter II中,荧光单克隆抗体与单核细胞(t淋巴细胞和单核细胞)上的CD4或CD8抗原结合。在缓冲悬浮液中,络合物以单一的流通过流动比色器。复合物被波长为532 nm的固态激光激发,使复合物发出被光电倍增管捕获的光,并传输到计数的数字读出。42].
过程:将20 ml CD4或CD8单克隆抗体引入Rohren试管中,加入6 h内收集的混合良好的全血20 ml。混合后室温黑暗孵育15分钟。加入800 μ l的no-lyse缓冲液,混合后在Sysmex/Partec Cyflow计数器II上读取。将制备好的样品插入Cyflow端口,进行采集和数据分析。Cyflow从预运行,运行,计数和停止开始。Cyflow计数已知体积的样本并停止。Cyflow操作是一个实际的容量绝对计数。它只计算制备样品的0.2mls。对于CD4或CD8 t淋巴细胞的绝对计数,重要的值是血液中获得的计数/µl。计算结果如下:
式中n = count/µl;稀释系数= 42。
实时聚合酶链反应(RT-PCR)检测病毒载量
样品和对照准备:每个样本的1050µl通过微移管与对照一起涡旋转移到输入-5管[43].将所有标本及对照品从高(+)、低(+)、负(−)依次送入样品/对照架。样品/对照架装入仪器。
Map(磁性玻璃粒子)
该过程包括三个阶段:裂解、稳定和脱蛋白——加入裂解缓冲液,样品得到完全裂解。DNA和RNA被释放,同时通过蛋白酶消化降解抑制蛋白和RNase,并通过潮盐、还原剂和洗涤剂灭活核酸酶来稳定。溶解缓冲液释放的总核酸通过捕获与添加的磁性玻璃颗粒(MGP)的二氧化硅表面结合。加入洗涤缓冲液以去除未结合的物质,并允许杂质,如变性蛋白、细胞碎片和潜在的PCR抑制剂。纯化后的总核酸在高温(80°C)、高pH、低盐浓度条件下通过洗脱过程释放,这些活动均在无菌II类生物安全柜中进行。然后将k管转移到COBAS Taqman进行扩增。结果在Amplink中被读取为拷贝数/ml [43].血液样本由一名训练有素的技术人员使用静脉穿刺抽取,然后离心,分装到血浆中,然后在−80°C的冰柜中储存0.5 ml等份。额外的样本留在生物标本库中供将来使用。
提取龈上斑块的DNA/RNA
在抵达美国SC克莱姆森后,我们对菌斑样本进行了检查,以确保它们仍然是冷冻的。样品经冷冻验证后,保存在−80°C。150份龈上斑块样品用于DNA提取。使用Qiagen DNeasyPowerBiofilm Kit (Qiagen, USA)按照制造商的程序提取DNA。每组提取液均设提取空白,以监测外界污染情况。提取成功后,使用Qubit 3.0 (Thermo Fisher, USA)测量每个提取样品的基因组DNA浓度。
新一代测序
为了描述唾液和牙菌斑样本的完整细菌群落,我们使用基因片段元条形码方法,使用先前发表的引物,靶向16S rRNA基因的V4高变区[44,45].由于16S rRNA扩增子测序一般只能将类群划分到属水平(分类组间分辨率不同)[46],我们开发了两组引物,以30S-S11和50S-L6 rRNA基因片段为目标,来表征两个重要口腔群体的菌株水平多样性,链球菌种虫害和奈瑟氏菌属分别spp。。除了细菌群落,我们还利用针对真核rDNA复合体ITS2区域的真菌特异性引物生成了口腔真菌群落的数据[47].每个数据集被构建到Illumina库中,并在MiSeq上使用对端2 × 250nt reads进行测序。我们首先使用Cutadapt[从原始fastq文件中删除primer和适配器序列。48].接下来,我们质量过滤,合并对端读数据,去除嵌合序列,并使用DADA2管道从修剪后的读数据中生成扩增子测序变异体(asv) [49].最后,我们使用VSEARCH[对每个ASV进行分类]50使用细菌EzBiocloud [45]或真菌UNITE [51]数据库作为参考。多样性分析主要在R环境中进行[52使用PhILR [53],素食[54]和Phyloseq [55],取决于扩增子的长度。
数据处理和质量控制
每次研究访问结束后,研究人员都会检查纸质研究表格的准确性和完整性。纸质表格被扫描并以电子方式输入数据管理系统。生活质量(QoL)自我报告数据转移到REDCap。数据库管理员、研究协调员和pi定期检查数据的不准确性和差异。这项研究的重要组成部分已得到成功实施。数字3.给出了该研究的数据存储库的概述。
在贝宁大学教学医院(UBTH)内的−80°C冰柜处理和/或储存前,生物样本要进行准确的标记。对所有唾液、口腔拭子和菌斑样本进行质量控制检查。样本在干冰下运送到克莱姆森大学进行处理/测序)和罗格斯大学(用于生物银行)。PI (Coker)在每个访问周期开始时访问站点,并进行培训,以确保以最高质量收集临床和牙科参数。此外,研究人员和研究人员之间每两周举行一次电话会议,以解决与研究招聘、后勤或管理有关的任何问题。
校准
在每次研究开始前(基线、就诊2和就诊3)进行龋齿鉴定和分类的校准。在校准检查者-牙医时,确定检查者之间和检查者内部的可靠性。检查牙医接受训练,校准准确的DMFT(龋齿,缺失,补牙)图。评估者的信度是通过比较每个检查牙医的评估与金标准检查者的评估来确定的。通过比较每个牙医检验员对同一参与者的评估来确定内部评分者的信度。在每次校准过程中,对两名患有龋齿的儿童进行了筛查。
检查校准。为了减少检查人员之间的数据收集不一致,包括龋损分类和现有修复的记录,该研究对检查牙医进行了培训,以校准准确的DMFT(龋齿、缺失、填充牙)图表。
在2019年至2020年期间的三个校准阶段(V1、V2和V3)中,对参与者组(HI、HEU和HUU)上的三名检验员(牙医)进行校准。Kappa统计数据用于确定独立审查员之间的可靠性的22试点参与者在三个会议。
权力
在之前的16S扩增子测序工作(PI-Richards)中,对年龄相近的龋齿活跃儿童进行了研究[56],我们在一次MiSeq测试中使用v2化学方法对185个样本进行了测序。这产生了平均64,938次读取/样本。基于上述六个样品类别(CF-PF、CAE-PF、CAE-PE、CA-PF、CA-PE和CA-PD),并给定相似的测序深度(每次MiSeq运行192个样品),基于模拟的功率分析估计,50个样品/类别将导致总功率超过0.99。本次幂次分析中,我们从一个无限总体中随机抽取了1000个模拟数据集,其多变量分布与之前对相似年龄范围的龋齿活跃儿童的研究相同。对于每个模拟数据集,在5%水平上使用1000个随机排列并通过R包素中的阿多尼斯函数利用Bray-Curtis不相似性指数进行置换多元方差分析(PERMANOVA)检验。57].
讨论
本队列研究的主要目标是根据感染艾滋病毒的母亲所生儿童的六种特定龋齿疾病状态,使用不同牙齿的特定位点采样来表征口腔细菌和真菌微生物群。本研究邀请符合条件的儿童的父母/照顾者参与。这份报告描述了招聘策略和研究协议。DOMHaIN的研究结果将支持HIV感染和龋齿之间的微生物联系。我们将能够检查唾液流量和pH值在感染艾滋病毒儿童龋齿风险中的作用。通过DOMHaIN研究中龋齿的纵向测量,我们将调查龋齿相关的危险因素。我们还打算探索免疫和炎症标志物与围产期艾滋病毒感染和暴露龋齿之间的关系。
DOMHaIN队列研究填补了理解口腔微生物组和疾病结果之间关系的重要空白。前瞻性研究设计、队列参与者规模以及与一项名为“微生物组影响尼日利亚感染艾滋病毒儿童的生长和发育”(MARGIN)的出生队列研究的联系是至关重要的优势。据我们所知,DOMHaIN的研究是第一个能够回答儿童口腔微生物组如何随着年龄变化的问题,确定口腔微生物组组成与龋齿开始和发展的关系,同时探索口腔微生物组与儿童结果(如肥胖、心脏病、结核病和牙周病)的关联的研究。这一前瞻性的以学龄儿童为重点的队列研究使我们能够研究混合牙列阶段微生物定植和演替的个体决定因素、比率和模式。新的宏基因组技术的使用是另一个优势,因为该队列产生的数据位于流行病学、微生物学、生物信息学和生物统计学的交叉。完成后,数据可用于回答关于幼儿口腔微生物组和艾滋病毒疾病进展的广泛问题。
该队列研究的主要限制是,我们无法分离ART对龋齿发病率的影响,因为在UBTH的HI儿童在按照国家指南加入艾滋病毒护理项目后立即接受抗逆转录病毒治疗。这可能会影响研究结果,因为抗逆转录病毒疗法会影响口腔菌群和一般口腔健康[58,59].此外,大多数艾滋病儿童接受了类似的药物治疗,因此,我们没有能力检查特定的抗逆转录病毒治疗方案对口腔微生物群的影响。虽然没有放射学调查来客观评估龋齿或涉及牙髓的龋齿病变,但牙科检查人员是经过良好训练和校准的。为了在一定程度上缓解这些弱点,我们将能够将我们的一些发现与尼日利亚的其他研究小组进行比较,我们正在与其他国际研究小组开展合作。
我们还获得了宝贵的经验教训,适用于对撒哈拉以南非洲的微生物组研究感兴趣的研究人员。也许最有用的是,在为人类微生物组研究组织队列研究时,跨学科的研究人员之间合作的重要性,制定从口腔等专门部位收集的样本中提取DNA和RNA的方案,以及处理微生物组分析的样本。不同专业领域(流行病学、牙科/口腔生物学、统计学、生物化学和生物信息学)的研究人员之间的合作使这项研究取得了成功。
据我们所知,还没有一项研究前瞻性和全面地研究了幼儿的牙齿特异性微生物群与HIV感染、暴露和治疗的关系。DOMHaIN方案旨在检查早期生活因素,包括围产期艾滋病毒感染和暴露,假设有助于龋齿。这项拟议的研究将通过全面研究龋齿的六个进展阶段以及整合真菌和细菌转录组学,有助于我们了解在艾滋病毒预防和治疗背景下的疾病进展。通过DOMHaIN研究,更全面地了解艾滋病毒感染儿童龋齿发展的不同阶段的机制,将为开发新的预防和治疗干预措施提供见解。
合作目标
我们希望通过多次合作来实现我们的研究目标,但我们也欢迎进一步的建议。我们可以处理广泛的研究问题与广泛不同的口腔和血液样本和详细的临床和饮食信息在我们的处置。因此,有意合作者应联系本队列研究的通讯作者以获得进一步的细节。
数据和材料的可用性
所有宏基因组和元转录组序列数据将在科学文章中发表结果后,在国家生物技术信息中心(NCBI)的序列读取存档(SRA)数据库中公开。由于伦理上的原因,如果没有提交研究计划等申请程序,问卷和临床数据即使以去识别的形式也无法自由获取。研究计划将先经过研究科学委员会的评估,然后再经过相关研究伦理委员会的评估。
缩写
- 16 s:
-
16 .核糖体小亚基沉积系数组分
- 艺术:
-
抗逆转录病毒疗法
- CA:
-
蛀牙活跃于牙本质
- CAE:
-
蛀牙活跃在牙釉质中
- 疾病预防控制中心:
-
疾病控制中心
- CF:
-
Caries-free
- 背景:
-
脱氧核糖核酸
- DOMHaIN:
-
尼日利亚幼儿龋齿及其与口腔微生物和HIV的关系
- ECC:
-
儿童早期龋齿
- 鸡尾酒疗法:
-
高活性抗逆转录病毒治疗
- 高浓缩铀:
-
HIV-exposed-uninfected
- 你好:
-
hi感染
- 艾滋病毒:
-
人类免疫缺陷病毒
- HUU:
-
HIV-unexposed-uninfected
- ICDAS:
-
《国际龋齿检测与评估
- 其:
-
内部转录间隔区
- 体育:
-
牙菌斑被确认为龋齿,在牙釉质中活跃
- 帕金森病:
-
牙菌斑被确定为龋齿,在牙本质中活跃
- PI:
-
首席研究员
- RNA:
-
核糖核酸
- 核糖体rna:
-
核糖体核糖核酸
- rt - pcr:
-
实时聚合酶链反应
- 颞下颌关节:
-
Tempomandibular联合
- 人:
-
世界卫生组织(who)
参考文献
- 1.
Rajonson N等人。与未受感染的兄弟姐妹相比,西非感染艾滋病毒的儿童患龋齿的比例较高。公共卫生学报。2017;77(3):234-43。
- 2.
焦克M,等。尼日利亚儿童围产期艾滋病毒感染和暴露与龋齿的关系中华儿科杂志;2018;37(1):59-65。
- 3.
见面有摩根大通。接受抗逆转录病毒治疗的hiv感染儿童龋齿患病率及其与免疫状况的相关性儿科学报。2011;12(2):87-90。
- 4.
Joosab Z, Yengopal V, Nqcobo CB。在南非豪登省约翰内斯堡的一个儿科病毒学门诊病房,感染艾滋病毒的4至10岁儿童的龋齿流行率。SADJ。2012年,67(7):314 - 7。
- 5.
Obileye MF,等。尼日利亚感染艾滋病毒儿童的龋齿状况。中华医学杂志2009;19(4):210-3。
- 6.
Tofsky N等。感染艾滋病毒儿童与家庭同龄人的龋齿:两年的调查结果。Pediatr削弱。2000;22(3):207 - 14所示。
- 7.
Hicks MJ等人。hiv感染儿童龋齿:一项纵向研究Pediatr削弱。2000;22(5):359 - 64。
- 8.
Madigan A等人。艾滋病毒阳性儿童及其兄弟姐妹的龋齿经历和致龋标志物。Pediatr削弱。1996;18(2):129 - 36。
- 9.
Valdez IH, Pizzo PA, Atkinson JC。儿科艾滋病患者口腔健康:一项基于医院的研究中国儿童医学杂志。2002;20(2):357 - 361。
- 10.
Howell RB,等。感染艾滋病毒儿童的龋齿。Pediatr削弱。1992;14(6):370 - 1。
- 11.
Kistler JO等人。人体免疫缺陷病毒(HIV)阳性个体的口腔微生物组医学微生物学杂志。2015;64(9):1094-101。
- 12.
李洋,等。唾液中的HIV感染和微生物多样性。临床微生物学杂志,2014;52(5):1400-11。
- 13.
Dang AT,等。未经治疗的艾滋病毒感染患者舌菌群中增加的致病足迹的证据。BMC Microbiol。2012;12:153。
- 14.
Beck JM,等。hiv感染者和未感染者肺部和口腔微生物群的多中心比较中华医学会呼吸与危重症分会。2015;19(11):1335-44。
- 15.
Goldberg BE等人。HIV感染控制良好和未感染的儿童口腔细菌群落《公共科学图书馆•综合》;2015.10(7): p . e0131615。
- 16.
穆克吉PK.,等。hiv感染患者口腔真菌群系分析:毕赤酵母作为机会性真菌拮抗剂的鉴定公共科学图书馆Pathog;2014.10(3): p . e1003996。
- 17.
Hegde MC,等。口腔菌群:hiv患者与正常患者的比较研究。Otolaryngol头颈外科2014;66(增刊1):126-32。
- 18.
穆克吉PK等人。HIV感染者口腔细菌和真菌微生物群的生态失调与HIV感染的临床和免疫变量相关。《公共科学图书馆•综合》,2018年版。13(7): p . e0200285。
- 19.
Moyes DL,等。HIV疾病中的肠道和口腔微生物组:讲习班报告。口腔医学杂志2016;22(增刊1):166-70。
- 20.
Saxena D,等。人类微生物与艾滋病。艾滋病代表2012;9(1):44-51。
- 21.
刘刚,等。HIV感染影响变形链球菌的水平,但不影响基因型。中国地质大学学报(自然科学版)2012;
- 22.
Starr JR等人。围产期获得性HIV感染青年的口腔菌群。微生物。2018;6(1):100。
- 23.
Brennan AT,等。一项荟萃分析评估了暴露于hiv的未感染婴儿和儿童与未暴露于hiv的未感染婴儿和儿童的全因死亡率。艾滋病。2016; 30(15): 2351 - 60。
- 24.
Evans C, Jones CE, Prendergast AJ。感染艾滋病毒、未受感染的婴儿:消除儿科艾滋病毒时代的新的全球挑战。《柳叶刀》杂志2016;16(6):e92-107。
- 25.
刘志强,等。尼日利亚儿童围产期艾滋病毒感染和暴露与龋齿的关系儿科感染Dis . 2017。
- 26.
Jumare J,等。在尼日利亚,接触艾滋病毒但未受感染的儿童与未接触艾滋病毒的儿童相比增长缓慢。中华儿科杂志2019;38(3):280-6。
- 27.
Coker MO,等。免疫状态,而不是艾滋病毒感染或暴露,驱动口腔菌群的发展。Sci众议员2020;10(1):10830。
- 28.
le Roux SM等。在南非普遍抗逆转录病毒治疗条件下,暴露于hiv病毒的未感染婴儿的传染性发病率:一项前瞻性队列研究柳叶刀儿童青少年健康,2020年。
- 29.
尼日利亚联邦卫生部2018年艾滋病毒/艾滋病指标和影响调查(NAIIS):技术报告。2019年:尼日利亚阿布贾。
- 30.
《国家艾滋病预防治疗和护理指南》,2016年。
- 31.
国家艾滋病控制机构,n艾滋病毒和艾滋病国家战略框架:2017-2021年。2017.
- 32.
Poh BK等人。马来西亚巴生谷幼儿园5-6岁幼儿的营养状况、饮食摄取模式及营养知识。J减轻。2012;18(2):231 - 42。
- 33.
世界卫生组织。口腔健康调查:基本方法,1997年第4版,世界卫生组织。
- 34.
国际龋齿检测和评估系统(ICDAS II)的基本原理和证据,在临床模型研讨会:remind - demin, Precavitaion,龋齿:第七届印第安纳会议的会议记录。2005年:美国印第安纳波利斯。p . 161 - 221。
- 35.
Rashed MA, Taha SE。口腔卫生指数简化为高低社会经济水平(9-13岁)学龄儿童。中国地质大学学报(自然科学版)1995;
- 36.
Greene JC, Vermillion JR.简化口腔卫生指数。邓特协会1964;68:7-13。
- 37.
莫Folayan MO等。尼日利亚半城市居民儿童的一般焦虑、牙科焦虑、吮指、龋齿和口腔卫生状况。BMC口腔健康杂志2018;18(1):66。
- 38.
纳西门托,M.M.等。口服精氨酸代谢可以降低儿童龋齿的风险。J登特·雷斯,2013年。
- 39.
do Nascimento, C.等。温度和贮存时间对用棋盘DNA-DNA杂交法检测口腔微生物的影响Arch Oral Biol, 2014。59(1): 12-21页。
- 40.
Katsoulis J,等。样品保存对牙周细菌检测的影响。口腔微生物免疫学。2005;20(2):128-30。
- 41.
查尔斯TEO。人类免疫缺陷病毒检测算法在资源受限环境中的应用[互联网],S. Saxena,编者。2013:InTech。
- 42.
等。Partec CyFlow计数器可以在马拉维地区一级扩大抗逆转录病毒治疗的背景下,为CD4+ t细胞监测提供一种选择。中国医学杂志2006;100(10):980-5。
- 43.
Pas, S.等。用于人类免疫缺陷病毒1型RNA定量的Roche Cobas AmpliPrep/Cobas TaqMan HIV-1新测试2.0版本的性能评估中国Microbiol;2010.48(4): 1195 - 200页。
- 44.
滕芳,等。DNA提取方法和靶向16S-rRNA高变区对口腔微生物区谱的影响Sci众议员2018;8(1):16321。
- 45.
尹盛,等。EzBioCloud: 16S rRNA基因序列和全基因组组装的分类统一数据库。中国生物医学工程学报,2017;30(5):329 - 331。
- 46.
Johnson JS等。16S rRNA基因测序用于物种和菌株水平微生物组分析的评价Nat Commun。2019;10(1):5029。
- 47.
Caporaso JG等。16S rRNA多样性的全球模式,深度为数百万个序列每个样本。美国国家科学院。108(1): 4516 - 2011; 22。
- 48.
Martin, M. Cutadapt从高通量测序读取中移除适配器序列。EMBnet。j . 2011;17日,10 - 12页。
- 49.
Callahan BJ等人。DADA2: Illumina扩增子数据的高分辨率样品推断。Nat方法。2016;13(7):581 - 3。
- 50.
Rognes, T.等。一个通用的宏基因组学开源工具。PeerJ, 2016年。4: p . e2584。
- 51.
Nilsson RH等。真菌分子鉴定数据库:处理暗分类和平行分类。2019;47(D1): D259-64。
- 52.
统计计算的语言和环境。计算,2006年。1.
- 53.
西尔弗曼,JD。,等。系统发育转化增强了微生物群组成数据的分析。Elife, 2017;6.
- 54.
Dixon, P. VEGAN,社区生态的R功能包。植物学报,2003。14(6): 927 - 930页。
- 55.
Phyloseq:用于微生物组普查数据的可重复性交互分析和图形的R包。《公共科学图书馆•综合》。2013;8 (4): p . e61217。
- 56.
Richards VP等人。不同龋齿状况儿童部位特异性牙菌斑的微生物群研究。感染Immun, 2017。85(8)。
- 57.
Dixon P. VEGAN,一套社区生态R功能包。植物学报2003;14(6):927-30。
- 58.
Griffen AL,等。多因素分析显示HIV/HAART对口腔菌群有显著影响。Sci众议员2019;9(1):19946。
- 59.
Pinto-Cardoso S, Klatt NR, Reyes-Teran G.抗逆转录病毒药物对微生物群的影响:重要问题的未知答案。Curr评论艾滋病。2018; 13(1): 53-60。
确认
研究人员,尤其是Christy Ndekwu护工、Uwagboe Odigie博士、Oyemwen Olaye女士、Ehioze Awanlemhen女士、Samuel Chukwumaeze先生、Matthew Imoe先生、Daniel Oakhu先生和Susan Dare女士在招募、样本和数据收集方面受到了认可。作者感谢Osasumwen Ehigie先生、Kelly Avenbuan先生和Amara Godwins女士对实验室管理和样品处理的支持。Drs。Nonso Onyia, Stanley Iyorzor, Owen Omorogbe和Chioma Ugorji因其在研究访问期间的临床检查以及在招募和日程安排上的灵活性而受到认可。作者对DOMHaIN研究家庭在参与期间付出的时间、努力和卓越的承诺表示感谢。
资金
国家卫生研究所/国家牙科颅面研究所(R01DE028154)为该队列研究提供了资金。资助人在研究的设计、收集分析和数据的解释以及撰写手稿中没有任何作用。
作者信息
从属关系
贡献
MOC设计和建立了临床队列,MOC和VR获得了该队列的资金。MOC和PA设计了在线问卷。AO和OO在现场担任研究人员,提供临床监督。MOC、PA、EO负责队列的持续管理,OI负责数据的管理。EO和NI收集和归档样本,用于招聘、沟通和传播目的。MOC、PA、EO、OI和NI分析了初步结果。所有作者起草和编辑稿件。文化部修订了主要内容。所有作者都严格审查并批准了最终稿。所有作者阅读并批准最终稿。
相应的作者
道德声明
伦理认可和同意参与
马里兰大学巴尔的摩分校(HP-00084081)、罗格斯州立大学新泽西分校(Pro2019002047)和贝宁大学教学医院(ADM/E22/A/VOL)的机构审查委员会。尼日利亚VII/14713)批准了这项研究。在告知父母/监护人或照顾者研究的细节,并且他们的参与是自愿的之后,获得书面知情同意。
同意出版
发表征求了参与者的同意。
相互竞争的利益
所有作者没有竞争利益声明。
额外的信息
出版商的注意
施普林格《自然》对出版的地图和机构附属关系中的管辖权要求保持中立。
补充信息
额外的文件1
.HIV检测和状态确定的补充方法:研究程序。
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议授权,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和源代码,提供知识共享许可协议的链接,并说明是否进行了修改。本文中的图像或其他第三方材料均包含在本文的知识共享许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的知识共享许可中,并且您的预期使用不被法定法规允许或超过允许的使用,您将需要直接从版权所有者获得许可。如欲查阅本牌照副本,请浏览http://creativecommons.org/licenses/by/4.0/.知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在对数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
科克,作案手法,阿克希贝,P,奥萨吉,E。et al。尼日利亚(DOMHaIN)幼儿龋齿及其与口腔微生物群和HIV的关系:一项队列研究。BMC口腔健康21日,620(2021)。https://doi.org/10.1186/s12903-021-01944-y
收到了:
接受:
发表:
关键字
- 艾滋病毒
- 龋齿
- 口腔微生物
- 队列
- 孩子们
- 牙菌斑