摘要
背景
尼古丁是牙周炎的重要危险因素和主要毒性成分。然而,尼古丁诱发牙周炎的机制尚不清楚。研究尼古丁通过α7烟碱乙酰胆碱受体(α7 nAChR)调节人牙周韧带细胞(hPDLCs)自噬的机制,以及自噬如何进一步调节hPDLCs中IL-1β的释放和IL-8的分泌。
方法
从拔牙牙根中获得HPDLCs,在α-白兔毒素(α-BTX)或3-甲基ladenine (3-MA)中预孵育,然后在尼古丁中培养。我们采用多种实验检测技术,包括western blotting、免疫荧光、酶联免疫吸附试验(ELISA)、透射电镜(TEM)和RT-qPCR,评估LC3蛋白、自身溶酶体的表达以及IL-1β和IL-8从hPDLCs中的释放。
结果
Western blots、免疫荧光和TEM结果发现,尼古丁显著增加hPDLCs自噬表达,这种自噬表达呈时间和浓度依赖性,α-BTX处理可逆转(p< 0.05)。RT-qPCR和ELISA结果显示,尼古丁对hPDLCs中炎症因子IL-1β和IL-8的释放有显著的响应。RT-qPCR和ELISA结果显示,尼古丁可显著上调hPDLCs中炎症因子IL-1β和IL-8的释放,而3-MA可抑制这一作用(p< 0.05)。
结论
尼古丁通过α7 nAChR调节hPDLCs的自噬,进而调节hPDLCs释放炎症因子1L-1β和1L-8。
背景
牙周炎是一种慢性进行性传染病,总患病率高达45-50%,最严重的牙周炎影响世界人口的11.2%,是人类第六大常见疾病[1,2].吸烟已被认为是牙周炎发生和发展的主要危险因素之一[3.].尼古丁是烟草中毒性最大的物质之一。4].可引起人体牙周组织病理改变,促进牙槽骨吸收,最终导致牙齿脱落[5].
α7烟碱乙酰胆碱受体(α7 nAChR)是烟碱乙酰胆碱受体(nAChRs)的一个主要亚基,也是尼古丁结合受体的一个有效靶点[6].在此之前,我们已经证实了α7 nAChR在牙周韧带(PDL)组织和人牙周韧带细胞(hPDLCs)中的功能性表达。尼古丁可增强PDL组织和hPDLCs中α7 nAChR的表达,激活炎症相关信号通路,进而调节IL-1β、IL-8等炎症因子的分泌[6,7,8].
自噬是一种重要的细胞机制,在正常生理过程中起着“内务”作用,包括清除长寿命、聚集和错误折叠的蛋白质,清除受损的细胞器,调节生长和衰老[9].
自噬是一个动态的多步骤过程,包括自噬体的形成,自噬体与溶酶体融合形成自溶酶体,最后自溶酶体内容物降解[10,11].测量细胞中荧光标记的LC3点和自溶酶体可作为量化自噬的一种方法[10].
自噬可影响多种炎症性疾病的发病机制[12].近期研究表明牙周组织存在自噬,可能与牙周炎有关[9].例如,牙周炎患者自噬相关因子的表达升高[13].此外,自噬在不同条件下也对hPDLCs产生多重影响[14].近年来,尼古丁与自噬的相互作用被广泛讨论[15].此外,尼古丁通过nachr调节其他类型细胞的自噬过程[16].因此,我们认为自噬也可能通过调节炎症相关信号参与吸烟相关性牙周炎,从而导致炎症性疾病和牙周组织损伤。
鉴于此,本研究旨在探讨尼古丁通过α7 nAChR调节hPDLCs自噬的机制,以及自噬如何进一步调节炎症因子IL-1β和IL-8在hPDLCs中的分泌。
方法
hPDLCs的分离与培养
目前的研究包括无龋齿和牙周健康的前磨牙(n = 14),因正畸原因从年轻患者(12-16岁)中拔除。我们获得了中国第四军医大学口腔医学院伦理审查委员会的批准。儿童的父母/监护人被告知研究的目的和将拔牙纳入研究,并以书面形式提供知情同意。将拔下的牙齿清洗后保存在含有15%胎牛血清(FCS) (Hyclone)和抗生素(Invitrogen)的DMEM (Hyclone)中。hPDLCs的分离和培养如前所述[17].为了避免牙龈和牙髓组织的污染,使用锋利的手术刀从根的中间三分之一切除PDL组织。PDL组织在六孔板(Hyclone)中播种,在37°C、95%空气和5% CO的潮湿气氛中培养2.每3天更换一次培养基。在达到汇合后,细胞层被传代培养并用于进一步的实验。
尼古丁、α-BTX和3-MA治疗
根据以往的研究[8,18],本研究设计以不同浓度的尼古丁(Sigma)给hPDLCs (10−4, 10−5, 10−6, 10−7mol/L)作用12 h,或固定浓度(10−5mol/L)作用于不同时间(3,6,9,12,24 h)。为了证明尼古丁诱导的hPDLCs自噬是由α7 nAChR介导的,根据前人的研究[6,8],我们用α-BTX预处理hPDLCs (10−8mol/L, α7 nAChR特异性受体拮抗剂)(Tocris Bioscience),尼古丁前30分钟(10−5mol/L, 12 h)刺激。为了进一步研究自噬是否在hPDLCs炎症因子分泌中起作用,根据文献报道[19,20.],我们用3-甲基ladenine (3-MA)预处理hPDLCs (10−3mol/L,一种有效阻断自噬的PI3K抑制剂)(Sigma),在尼古丁(10−5mol/L, 12 h)刺激后,检测细胞自噬表达及IL-1β、IL-8分泌情况。
蛋白分离和Western blot
蛋白质提取如前所述[21].为了制备总细胞裂解液,将细胞(密度,1 × 106细胞/培养皿),然后用尼古丁、α-BTX或3-MA各种试剂处理,使用核提取试剂盒(Sangon Biotech)分离细胞蛋白。BCA试剂盒(Thermo)用于计算溶液中的蛋白质浓度。用SDS-PAGE分离蛋白质(40µg/lane),然后转移到PVDF膜(Millipore)上。在37℃下用溶解在含有0.1% Tween-20的tris缓冲盐水中的5%脱脂牛奶阻断1小时后,在4℃下用针对LC3B、Beclin-1、GAPDH(细胞信号技术)的一抗检测膜。清洗三次后,膜在37°C下用二抗孵育1小时。红外成像系统(奥德赛)用于评估印迹。展示了三个独立实验中的一个的代表性结果。
免疫荧光
对于免疫荧光,细胞在4%多聚甲醛中固定30分钟,用PBS (Hyclone)清洗,用0.5% Triton X-100在室温下渗透,用BSA (Sigma)阻塞2小时。然后用LC3B一抗(Cell Signaling Technology)以1:200稀释孵育细胞。细胞用PBS清洗,并用fitc标记的二抗(1:1000)孵育。用Hoechst (Sigma)染色的细胞核用荧光显微镜(Olympus FV1000)分析。在本研究中,免疫荧光点计数方法已在前面描述[22].展示了三个独立实验之一的代表性结果。
透射电子显微镜分析(TEM)
所制备的透射电镜样品如前所述[23].简单地说,细胞用2.5%戊二醛在0.1 mol/L的碳酸钙缓冲液中固定30分钟。有代表性的超薄切片用标准TEM方法分析。展示了三个独立实验之一的代表性结果。
实时定量pcr (RT-qPCR)
为了检测IL-1β和IL-8的表达,如前所述,分离总RNA并进行RT-qPCR检测[24].简单来说,我们使用TRIZOL试剂(Takara)按照厂家说明书提取总RNA,使用PrimeScript RT reagent Kit (Takara)合成cDNA。所有实验均以Mastercyclerep realplex (Eppendorf AG)和GAPDH为内标,一式三重复。使用以下引物序列:人IL-1β正向:5'-ATGATGGCTTATTACAGTGGCAA-3',反向:5'-GTCGGAGATTCGTAGCTGGA-3';人IL-8正向:5'-TTGCCAAGGAGTGCTAAAGAA-3',反向:5'-GCCCTCTTCAAAAACTTCTCC-3';GAPDH正向5'-ACCCACTCCTCCACCTTTG-3'',反向5'-ATCTTGTGCTCTTGCTGGG-3'。基因表达用2−ΔΔCq方法(25].实验一式三次。
酶联免疫吸附试验(ELISA)
如前所述,用ELISA法分析细胞培养上清,检测IL-1β和IL-8的释放[26].使用研发系统(Minneapolis)的高灵敏度ELISA试剂盒分析IL-1β和IL-8浓度,并归一化到细胞数。上清液解冻一次,所有测定同时进行。每组实验重复三次。
统计分析
所有重复实验数据均采用SPSS软件(Version 21, IBM)进行分析,以均数±标准差(mean±standard deviation, SD)表示。采用学生t检验比较对照组和治疗组,采用单因素方差分析进行多次比较。P< 0.05为差异有统计学意义。
结果
尼古丁增加了体内hPDLCs的LC3荧光点和自溶酶体
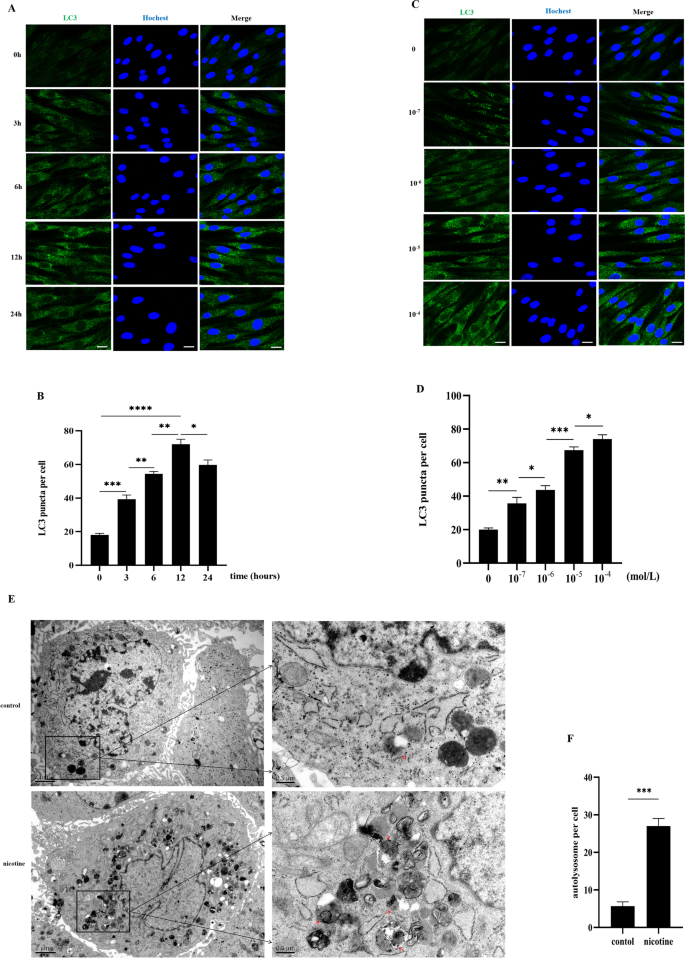
根据免疫荧光结果(图;1一个,B)、尼古丁(10−5mol/L)处理hPDLCs 3 h后,LC3荧光斑点显著增加(p< 0.001)。尼古丁治疗12小时后,增加达到峰值(p< 0.0001),之后下降(p< 0.05)。在hPDLCs上使用尼古丁12小时,我们观察到细胞核周围LC3荧光点状物呈剂量依赖性增加(图2)。1C,D)。在我们之前的研究中,发现尼古丁浓度大于10−5mol/L, hPDLCs活性显著降低[18].作为尼古丁(10−5mol/L)处理12 h后,hPDLCs自噬显著增强,后续实验选择这些条件。
尼古丁增加了hPDLCs的LC3荧光点和自溶酶体。一个尼古丁后hPDLCs中LC3荧光点状(10−5用共聚焦激光扫描显微镜免疫荧光法测定(0、3、6、12、24 h)的浓度。比例尺代表100µm。B柱状图显示每组至少10个细胞中每个细胞LC3荧光点的数量。C尼古丁后hPDLCs中LC3荧光点状(10−4, 10−5, 10−6, 10−7用共聚焦激光扫描显微镜免疫荧光法测定12 h时mol/L)。比例尺代表100µm。D柱状图显示每组至少10个细胞中每个细胞LC3荧光点的数量。E尼古丁诱导hPDLCs中自溶酶体的形成(10−5mol/L, 12 h),透射电镜观察。放大倍率4万倍。比例尺,0.5微米。红色箭头代表自溶酶体。F定量分析一个细胞内的自溶酶体,每组至少3个细胞进行统计。(*p< 0.05, **p< 0.005, ***p< 0.001, ****p< 0.0001)
在随后的实验中,我们使用TEM在该浓度的尼古丁作用下验证了hPDLCs中自溶酶体的形成(10−5mol/L)和时间(12 h)。1E,F)显示尼古丁处理的hPDLCs中有更多的自溶酶体(p< 0.001)。这部分结果表明尼古丁可以促进hPDLCs自噬的形成。
尼古丁对hPDLCs自噬的影响通过α7 nAChR介导
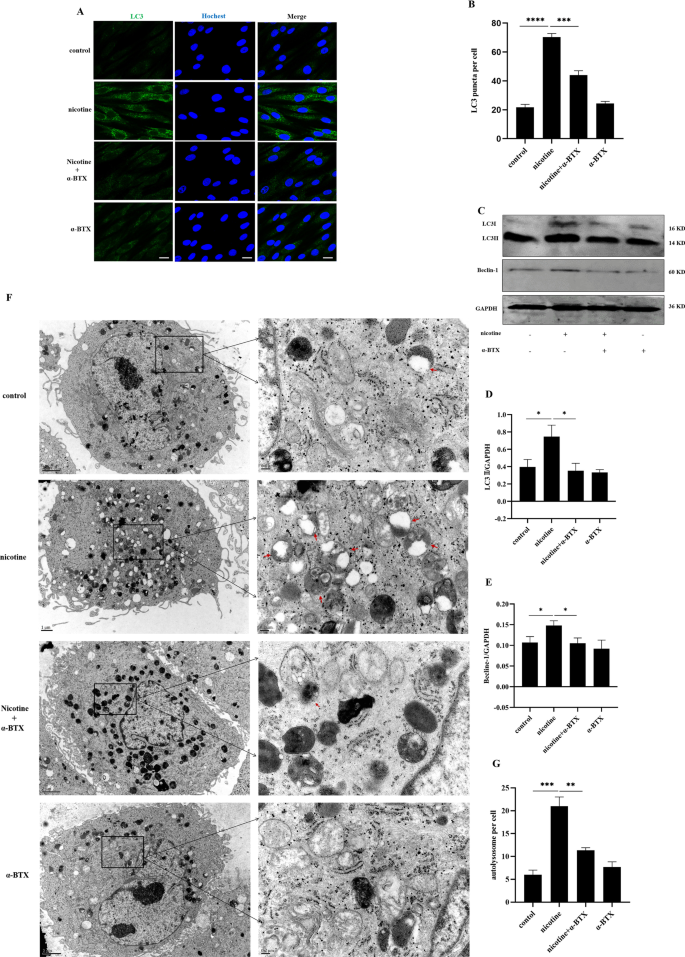
为了探索α7 nAChR在尼古丁诱导的hPDLCs自噬中的作用,我们用α-BTX预处理hPDLCs (10−8mol/L, α7 nAChR特异性拮抗剂),尼古丁前30 min (10−5mol/L, 12 h)刺激,并检测自噬相关蛋白和自溶酶体的表达。采用免疫荧光、Western blot和TEM检测hPDLCs的自噬表达。根据免疫荧光结果(图;2一个,B),尼古丁处理后的hPDLCs LC3荧光点状显著增加(p< 0.0001)。与尼古丁组比较,尼古丁联合α-BTX处理组LC3荧光点状明显减少(p< 0.001)。α-BTX单独组LC3荧光点数与对照组无显著性差异。根据Western blot(图;2C -E)和TEM(图;2F,G)结果,我们检测了hPDLCs中LC3II和Beclin-1蛋白的表达和自溶酶体的表达,结果与免疫荧光一致。因此,α-BTX处理阻断了尼古丁对hPDLCs自噬的调控。这表明尼古丁对hPDLCs自噬的影响是由α7 nAChR介导的。
尼古丁和/或α-BTX对hPDLCs自噬蛋白和自溶酶体表达的影响一个用共聚焦激光扫描显微镜免疫荧光法测定尼古丁和/或α-BTX后hPDLCs中的LC3荧光点状。比例尺代表100µm;B柱状图显示每组至少10个细胞中每个细胞LC3荧光点状的数量;CWestern blot检测hPDLCs中LC3II和Beclin-1蛋白的表达DLC3II蛋白定量分析。至少三个独立实验的数据以均数±标准差表示;EBeclin-1蛋白定量分析。至少三个独立实验的数据以均数±标准差表示;F用透射电镜观察尼古丁诱导的自噬(10−5mol/L, 12 h)和/或α-BTX (10−8mol/L, 12.5 h),放大倍率4万倍。比例尺,0.5微米。红色箭头代表自溶酶体;G定量分析一个细胞内的自溶酶体,每组至少3个细胞进行统计(*p< 0.05, **p< 0.005, ***p< 0.001, ****p< 0.0001)
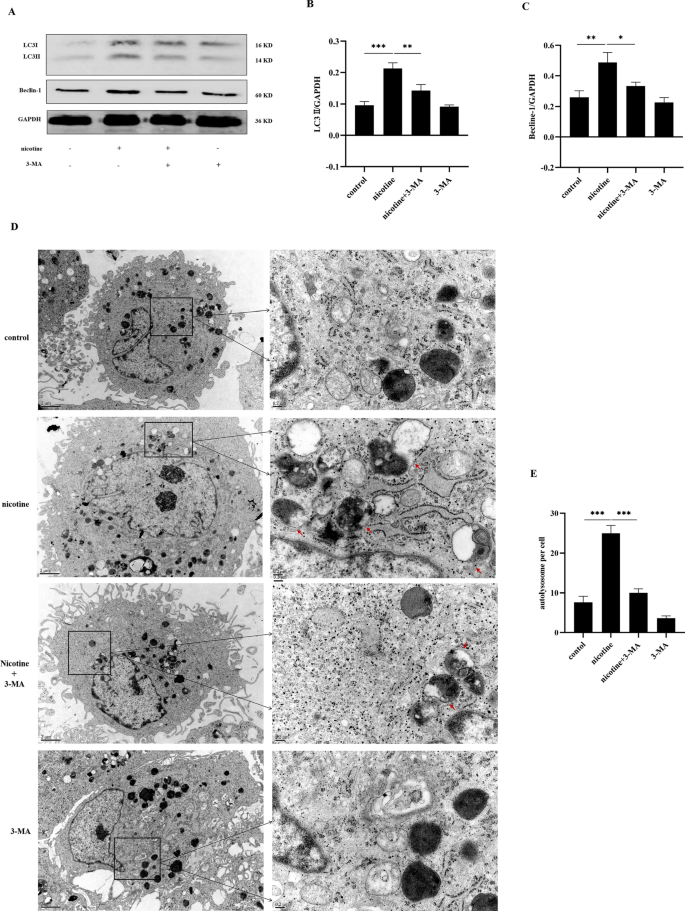
3-MA对尼古丁诱导的hPDLCs自噬表达的影响
为了进一步研究尼古丁和hPDLCs自噬之间的关系,我们用3-MA预处理了hPDLCs (10−3mol/L,一种有效阻断自噬的PI3K抑制剂),在尼古丁刺激前30分钟,并检测自噬相关蛋白和自溶酶体的表达。Western blot结果(图;3.A-C)显示尼古丁显著增加了hPDLCs中LC3II和Beclin-1的表达。与尼古丁组比较,尼古丁联合3-MA处理组LC3II和Beclin-1蛋白表达显著降低。我们还用透射电镜分析了自溶酶体的表达(图。3.D,E),结果也显示了相似的趋势,说明3-MA可以抑制尼古丁诱导的hPDLCs自噬。进一步说明了PI3K通路在尼古丁诱导的自噬中的作用。
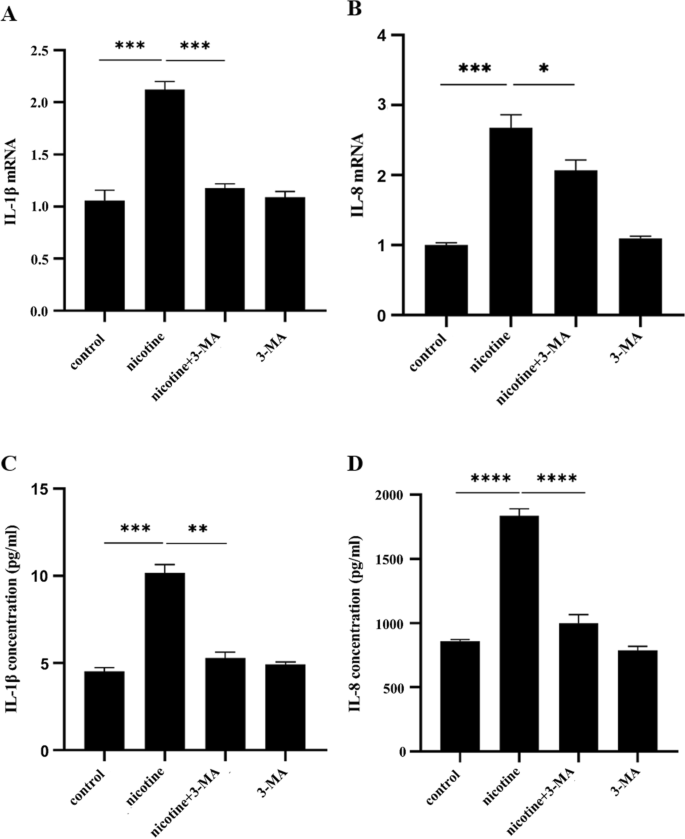
尼古丁可能部分依赖于α7 nAChR-PI3K通路诱导hPDLC分泌IL-1β和IL-8
在我们之前的研究中,我们已经多次证明尼古丁通过α7 nAChR诱导hPDLCs中IL-1β和IL-8的产生。进一步研究自噬是否参与hPDLCs炎症因子的分泌。RT-qPCR和ELISA检测尼古丁和/或3-MA处理后hPDLCs中炎症因子的表达。RT-qPCR结果显示,尼古丁上调了hPDLCs中IL-1β和IL-8 mRNA的表达(图;4一个,B)。与尼古丁组比较,尼古丁联合3-MA处理组IL-1β、IL-8 mRNA表达明显降低(p< 0.001,p< 0.05)。IL-1β、IL-8 mRNA表达在3-MA单独组与对照组无明显差异(p> 0.05)。ELISA结果显示,尼古丁能显著促进hPDLCs分泌IL-1β和IL-8(图2)。4C,D),与尼古丁组相比,尼古丁联合3-MA治疗组IL-1β和IL-8的分泌明显减少(p< 0.005,p< 0.0001)。3-MA治疗组与对照组IL-1β、IL-8分泌无明显差异(p> 0.05)。总的来说,这些结果表明尼古丁诱导的hPDLCs产生IL-1β和IL-8部分依赖于α7 nAChR-PI3K通路。
讨论
本研究探讨尼古丁调节hPDLCs自噬从而上调hPDLCs释放炎症因子的机制。我们发现尼古丁通过α7 nAChR显著增强了hPDLCs的自噬和IL-1β和IL-8的分泌,从而加重了牙周组织的炎症反应和牙周炎。
自噬是一种细胞内过程,它降解细胞器或细胞成分,以确保维持细胞内稳态[27].自噬参与干细胞的更新、多能性、分化、增殖和衰老[28].近年来,牙源性干细胞因其间充质干细胞(MSC)样特性而受到越来越多的关注。牙髓干细胞激活自噬作为一种前生存细胞保护机制,以应对甲基丙烯酸羟乙基损伤[29].二甲双胍可能通过自噬相关信号通路减少ROS来防止暴露于多多巴胺模板羟基磷灰石的hPDLCs的细胞毒性,也可能增强hPDLCs的成骨分化[30.].
近年来研究发现牙周炎与hPDLCs的自噬密切相关[31].尼古丁是烟草中的有毒成分,也是引发牙周炎的重要危险因素[32].初步研究发现尼古丁可改变牙周组织细胞的形态和结构,引起牙周组织的病理改变[18,33].为了研究尼古丁在hPDLCs自噬中的作用,用不同浓度的尼古丁处理不同时间的hPDLCs。我们发现尼古丁诱导的hPDLCs自噬以剂量和时间依赖的方式(图。1)。与此一致的是,尼古丁增强了人类癌症结肠癌细胞和眼平滑肌细胞的自噬表达,且自噬表达表现出尼古丁浓度和时间依赖性[34,35].我们的体内研究结果表明,尼古丁可以上调hPDLCs的自噬表达。
α7 nAChR是nAChR的主要亚基,也是尼古丁结合受体的有效靶点[17].在之前的研究中,我们已经证实了α7 nAChR在PDL组织和hPDLCs中的功能表达,尼古丁可以上调α7 nAChR的表达[7,8,33].一些现有的研究已经证实了nAChRs、尼古丁和其他细胞类型的自噬之间的复杂联系[34].黄等人。[36]报道了尼古丁可上调SH-SY-5Y细胞中α7 nAChR的表达和自噬,而α7 nAChR特异性拮抗剂(α-BTX)可抑制尼古丁诱导的细胞自噬。与此一致的是,在本研究中,我们观察到α-BTX抑制尼古丁诱导的自噬(图。2),提示α7 nAChR与尼古丁诱导的hPDLCs自噬有关。据我们所知,这是第一个证明尼古丁通过α7 nAChR调节hPDLCs自噬的报道。
自噬在炎症和免疫反应的发生发展中起着重要作用[37].近年来,越来越多的体内外研究证实了自噬在牙周炎中的作用[9],但尚无足够证据证实自噬在牙周炎中的作用是保护性的还是病理性的[38].等人。[39]报道了牙周炎的自噬障碍与保护有关。炎性微环境下牙周韧带干细胞凋亡需要增加自噬。或者,Tsuda等人。[40]的研究结果显示,自噬在牙龈上皮细胞系中过度表达可诱导细胞死亡,提示其在牙周炎中的病理参与。在本研究中,我们发现使用尼古丁后,hPDLCs的自噬显著增强,并通过自噬增强IL-1β和IL-8的释放(图。4)。这一发现提示自噬与吸烟相关性牙周炎的发病机制有关。
此前,我们已多次证明尼古丁通过α7 nAChR诱导hPDLCs中IL-1β和IL-8的产生[6,8].研究发现尼古丁通过nAChR途径上调人牙龈上皮细胞中IL-8和IL-1β的表达[41].IL-1β不仅与吸烟相关的牙周炎有关,升高IL-1β还会引发一系列炎症反应,促进骨吸收[42].IL-8与牙周状况相关,龈沟液中IL-8水平对检测牙周组织炎症有重要价值[43].由此推测,IL-1β和IL-8可能是吸烟相关牙周炎的潜在治疗靶点。
自噬在决定IL-1β和IL-8的命运中发挥作用[44,45].据报道,炎症小体激活期间饥饿的巨噬细胞以自噬依赖的方式分泌IL-1β [46].此外,细胞内IL-1β与LC3点共定位,表明自噬过程与IL-1β分泌之间的交集[47].toll样受体介导的肠上皮细胞产生IL-8需要自噬[48].ATG可促进人气道上皮细胞释放IL-8,在成人哮喘发病机制中促进中性粒细胞性气道炎症[49].在我们的研究中,我们发现尼古丁可以上调LC3II、Becline-1蛋白的表达以及炎症因子IL-1β和IL-8的分泌。这一结果可以被3-MA抑制,这是一种PI3K抑制剂,可以有效地阻止自噬(图。3.而且4)。PI3K是一个复杂的信号系统。我们初步证实a7 nAChR/PI3K通路可通过尼古丁激活自噬,促进炎症因子IL-1β和IL-8的分泌。具体的分子机制有待进一步研究。
综上所述,尼古丁通过α7 nAChR调节hPDLCs的自噬水平,并显著增强IL-1β和IL-8的分泌,从而加重hPDLCs的炎症反应。虽然我们报道了有趣的发现,但这些结果是基于某些细胞在体外的反应,而不是模拟体内或临床条件。动物模型需要进一步的研究来证实本研究的结果。此外,还需进一步研究尼古丁-α7 nachr自噬通路与吸烟相关牙周炎的详细分子机制。
结论
尼古丁通过α7 nAChR调节hPDLCs的自噬,进而调节hPDLCs释放炎症因子IL-1β和IL-8。本研究为吸烟相关牙周炎的病理发展提供了实验依据,为吸烟相关牙周炎的发生发展提供了新的思路。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
缩写
- hPDLCs:
-
人牙周韧带细胞
- α7乙酰胆:
-
阿尔法7烟碱乙酰胆碱受体
- α-BTX:
-
Alpha-bungarotoxin
- 3-MA:
-
3-Methyladenine
- ELISA:
-
酶联免疫吸附试验
- 透射电镜:
-
透射电子显微镜
- PDL:
-
牙周韧带
- FCS:
-
胎牛血清
参考文献
- 1.
Sanz M, Marco Del Castillo A, Jepsen S, Gonzalez-Juanatey JR, D 'Aiuto F, Bouchard P, Chapple I, Dietrich T, Gotsman I, Graziani F,等。牙周炎和心血管疾病:共识报告。中华牙周病杂志。2020;47(3):268-88。
- 2.
Kassebaum NJ, Smith AGC, Bernabé E, Fleming TD, Reynolds AE, Vos T, Murray CJL, Marcenes W. 1990-2015年195个国家口腔疾病的全球、区域和国家患病率、发病率和残疾调整生命年:对全球疾病、损伤和风险因素负担的系统分析。中国生物医学工程学报,2017;29(4):344 - 344。
- 3.
Leite FRM, Nascimento GG, Baake S, Pedersen LD, Scheutz F, López R.戒烟对牙周炎的影响:前瞻性纵向观察和介入研究的系统回顾和荟萃分析。尼古丁烟草决议2019;21(12):1600-8。
- 4.
Carson SJ, Burns J.吸烟对成人牙齿脱落的影响。中国科学,2016;17(3):73-4。
- 5.
Takeuchi-Igarashi H, Kubota S, Tachibana T, Murakashi E, Takigawa M, Okabe M, Numabe Y.尼古丁暴露后牙周组织细胞基质重塑对纤维化的反应。牙科学。2016;104(1):35-43。
- 6.
吴丽珍,段德民,刘玉峰,葛旭,周泽峰,王新军。尼古丁通过上调IL-1β促进与CD4(+) T细胞共培养的人牙周韧带细胞的破骨形成。中华分子医学杂志,2013;31(4):938-42。
- 7.
周震,刘峰,王玲,朱波,陈艳,余艳,王霞。炎症与尼古丁协同作用的机制:通过磷酸化GSK-3β上调α7 nAChR的表达。中华细胞医学杂志,2020;24(4):2663-76。
- 8.
吴玲,周颖,周卓,刘艳,白艳,邢霞,王霞。尼古丁通过α7 nAChR/NF-κB通路诱导人牙周韧带细胞产生IL-1β和IL-8的体外研究。细胞物理与生物化学。2014;34(2):423-31。
- 9.
Greabu M, Giampieri F, Imre MM, Mohora M, Totan A, Pituru SM, Ionescu E.自噬是牙周炎发病和进化的主要步骤之一。分子。2020;25(18):4338。
- 10.
Pugsley人力资源。定量自噬:使用多光谱成像流式细胞术测量细胞中LC3点状和自溶酶体的形成。方法。2017;112:147-56。
- 11.
Ni HM, Bockus A, Wozniak AL, Jones K, Weinman S, Yin XM, Ding WX。GFP-LC3在自体溶酶体中的动态翻转。自噬。2011;7(2):188 - 204。
- 12.
李,李,李,等。自噬在人类疾病中的作用。中华实用医学杂志,2015;29(4):344 - 344。
- 13.
Bullon P, Cordero MD, Quiles JL, Ramirez-Tortosa Mdel C, Gonzalez-Alonso A, Alfonsi S, García-Marín R, de Miguel M, Battino M.牙周炎患者和牙龈成纤维细胞的自噬:揭示慢性疾病和炎症之间的联系。BMC医学2012;10:122。
- 14.
梅艳梅,李琳,王晓强,张敏,朱丽芳,付玉文,徐艳。AGEs通过活性氧诱导人牙周韧带细胞凋亡和自噬。中国生物医学工程学报。2020;21(2):344 - 344。
- 15.
邢锐,程旭,齐勇,田霞,闫春,刘东,韩艳。低剂量尼古丁通过上调HO-1表达促进心肌细胞自噬。生物化学与生物物理学报。2020;522(4):1015-21。
- 16.
王铮,刘波,朱娟,王东,王赟。尼古丁介导的血管平滑肌细胞自噬通过nAChRs/ROS/NF-κB信号通路加速动脉粥样硬化。动脉粥样硬化。2019;284:1-10。
- 17.
吴玲,杨凯,桂艳,王霞。尼古丁上调miR-30a直接靶向人牙周韧带细胞CCNE2,使细胞周期阻滞在G1期。中国生物医学工程学报。2020;32(3):354-61。
- 18.
周卓,李斌,董卓,刘峰,张颖,余燕,尚峰,吴林,王霞,金燕。尼古丁通过α7尼古丁乙酰胆碱受体调节Wnt通路影响牙周韧带干细胞成骨分化。PLOS ONE。2013; 8 (12): e83102。
- 19.
刘东,杨颖,刘强,王娟。3-MA抑制顺铂诱导的食管鳞癌细胞自噬的研究。Med Oncol(诺斯伍德,伦敦,英国)。28(1): 105 - 2011; 11。
- 20.
吴宜涛,谭海林,水革,Bauvy C,黄强,Wenk MR, Ong CN, Codogno P,沈慧敏。3-甲基腺苷通过对I类和III类磷酸肌醇3-激酶的不同时间抑制模式调节自噬的双重作用。中国生物医学工程学报,2010;29(4):457 - 457。
- 21.
Hahnvajanawong C, Sahakulboonyarak T, Boonmars T, Reutrakul V, Kerdsin A, Boueroy P.异莫rellin通过抑制NF-κB易位、磷酸化p38 MAPK通路以及MMP-2和uPA表达对胆管癌细胞的抑制作用中华医学杂志。2021;21(2):151。
- 22.
魏伟,安艳,安艳,飞东,王强。牙周炎患者牙周韧带间充质干细胞自噬激活促进血管生成。牙周病杂志,2018;39(6):718-27。
- 23.
张勇,张勇,金晓峰,周晓红,董晓红,于文涛,高文军。黄芪甲苷抗脑缺血再灌注损伤作用:通过促进p62 - lc3自噬抑制细胞凋亡分子。2019;24(9):1838。
- 24.
张松,李颖,涂莹。利多卡因通过调节MAPK/ERK/NF-κB信号通路来减轻cfa诱导的大鼠炎症性疼痛。中华实验医学杂志。2021;21(3):211。
- 25.
Livak KJ, Schmittgen TD。利用实时定量PCR和2(-Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25(4):402 - 8。
- 26.
葛旭,刘玉峰,王勇,吴丽珍,谭玲,刘峰,王新军。尼古丁对人牙周韧带细胞与CD4+ T细胞相互作用的影响。中国药理学杂志,2016;35(9):983-90。
- 27.
于磊,陈勇,萨图泽。自噬途径:细胞和分子机制。自噬。2018;14(2):207 - 15所示。
- 28.
Babaei G, Aziz SG, Jaghi NZZ。EMT,癌症干细胞和自噬;三个主要的转移轴。Biomed Pharmacother. 2021;133:110909。
- 29.
李文杰,李文杰,李文杰,李文杰。人牙髓干细胞自噬机制的研究进展。材料。2019;12(14):2285。
- 30.
杨铮,高旭,周敏,匡勇,向敏,李娟,宋娟。二甲双胍对羟基磷灰石模板培养人牙周韧带干细胞的影响。中华口腔科学杂志2019;27(3):210-21。
- 31.
张霞,金勇,王强,李敏,龙华,赖伟。牙周炎自噬介导的免疫微环境调节模式的改变。衰老。2020;13(1):555 - 77。
- 32.
Isik Andrikopoulos G, Farsalinos K, Poulas K.电子尼古丁输送系统(ENDS)及其在口腔健康中的相关性。毒物。2019;7(4):61。
- 33.
王晓娟,刘艳芳,王清云,Tsuruoka M, Ohta K,吴淑霞,Yakushiji M, Inoue T. α - 7烟碱乙酰胆碱受体在人牙周韧带成纤维细胞和大鼠牙周组织中的功能表达。中国生物医学工程学报,2010;40(2):347-55。
- 34.
闫海燕,温霞,陈丽珍,冯玉婷,刘海霞,曲伟,赵文华,徐德强,平娟。增强自噬通过Bcl10/p-p65通路抑制产前尼古丁暴露胎鼠胸腺细胞发育。生态毒理学环境通报。2021;207:111272。
- 35.
Pelissier-Rota MA, Pelosi L, Meresse P, Jacquier-Sarlin先生尼古丁诱导的细胞应激和人类癌症结肠癌细胞的自噬:通过上调Cox-2和PGE(2)的产生对细胞稳态的支持作用。中国生物化学杂志,2015;
- 36.
洪秀善,黄伟平,刘华昌,傅文敏。自噬保护神经元免受abeta诱导的细胞毒性。自噬。2009;5(4):502 - 10。
- 37.
Deretic V, Levine B.自噬平衡先天免疫炎症。自噬。2018;14(2):243 - 51。
- 38.
杨燕,黄燕,李伟。自噬在牙周病中的意义。中华牙周病杂志,2011;26(1):18-26。
- 39.
安艳,刘伟,薛萍,张艳,王强,金艳。炎性微环境下牙周韧带干细胞凋亡与自噬增加有关。临床牙周病杂志,2016;43(7):618-25。
- 40.
Tsuda H, Ochiai K, Suzuki N, Otsuka K.丁酸盐,细菌代谢产物,诱导牙龈上皮细胞凋亡和自噬细胞死亡。中华牙周病杂志2010;45(5):626-34。
- 41.
Kashiwagi Y, Yanagita M, Kojima Y, Shimabukuro Y, Murakami S.尼古丁在IL-1β或刺激后上调人牙龈上皮细胞IL-8表达p . gingivalis脂多糖通过烟碱乙酰胆碱受体信号。《口腔医学杂志》2012;57(5):483-90。
- 42.
程瑞,吴震,李敏,邵敏,胡涛。白细胞介素1β是牙周炎的潜在治疗靶点:综述。国际口腔科学,2020;12(1):2。
- 43.
白介素-8 (IL-8)水平与牙周病严重程度的关系:临床生化研究。印度学报,2013;24(2):188-92。
- 44.
Claude-Taupin A, Bissa B, Jia J, Gu Y, Deretic .细胞自噬在IL-1β输出和释放中的作用。中国生物医学工程杂志,2018;83:36-41。
- 45.
Korhonen E, Piippo N, Hytti M, Hyttinen JMT, Kaarniranta K, Kauppinen A. SQSTM1/p62在il -1β刺激的人视网膜色素上皮细胞中调节IL-8和MCP-1的产生。细胞因子。2019;116:70-7。
- 46.
Torp MK, Yang K, Ranheim T, Husø Lauritzen K, Alfsnes K, Vinge LE, Aukrust P, Stensløkken KO, Yndestad A, Sandanger Ø。哺乳动物雷帕霉素靶点(mTOR)和蛋白酶体可减弱小鼠原代心脏成纤维细胞中IL-1β的表达。前沿免疫。2019;10:1285。
- 47.
自噬和炎症信号通路之间的串扰:平衡防御和稳态。免疫学杂志,2016;16(11):661-75。
- 48.
Li YY, Ishihara S, Aziz MM, Oka A, Kusunoki R, Tada Y, Yuki T, Amano Y, Ansary MU, Kinoshita Y.自噬是toll样受体介导的肠上皮细胞产生白细胞介素8的必要条件。中华分子医学杂志,2011;27(3):337-44。
- 49.
范德龙,金邵,罗淑萍,杨爱恩,申玉生,叶延明,朴海山。自噬相关基因多态性与成人哮喘中性粒细胞性气道炎症的相关性。2016;31(2): 375-85。
确认
作者对第四军医大学临床医学院微生物学系表示衷心的感谢。
资金
本研究由国家自然科学基金(No. 81670988, 82100954)和陕西省科技计划项目(No. 2020sf -013)资助。
道德声明
伦理批准并同意参与
所有的方法都按照相关的指导方针和规定进行。组织取样方案由中国第四军医大学口腔医学院机构伦理审查委员会批准(批准号:;irb -转速- 20160360)。儿童的父母/监护人被告知研究的目的和将拔牙纳入研究,并以书面形式提供知情同意。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
图2和图3中western blot图像的原始版本。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
杜,Y,杨,K,周,Z。et al。尼古丁通过α7 nAchR调节人牙周膜细胞的自噬,促进炎症因子IL-1β和IL-8的分泌。BMC口腔健康21日,560(2021)。https://doi.org/10.1186/s12903-021-01894-5
收到了:
接受:
发表:
关键字
- 尼古丁
- 自噬
- α7乙酰胆
- 牙周炎