摘要
背景
翠绿菌群的菌株链球菌发起人牙表面的定植通常通常彼此共同结合放线菌naeslundii是培养的生物膜社区的另一个成员。这些相互作用通常涉及粘附介导的链球菌受体多糖(RPS)的识别。我们的研究目的是了解这些多糖在口腔生物膜发育中的作用。
方法
不同结构类型RPS已特征在于它们的反应用特异性抗体和凝集素样粘附素。对于生物合成的RPS链球菌基因簇进行了鉴定,测序,其特征在于和比较。使用特异性抗体和基因探针生物膜样品中检测到RPS产生细菌。
结果
6种不同类型的RPS已从代表性的翠绿类群中鉴定出来链球菌共同共同用A. Naeslundii.每种类型是由一个不同的六 - 或七糖重复单元的,所述结构含有的宿主样基序,要么GalNAcβ1-3Gal或Galβ1-3GalNAc。这些图案占RPS介导的认可,而这些多糖的其它功能都更加紧密地与RPS抗原有关。的RPS-依赖性相互作用口腔链球菌借A. Naeslundii促进这些细菌和生物膜形成流动唾液中的生长。在不同个体的常规链球菌植物区群中发现了RPS生产的特异性差异,提高了rps基生物膜社区组成的基于RPS的差异。
结论
链球菌RP的结构,功能和分子特性支持这些细胞表面分子在口服生物膜形成中的识别作用。
背景
人类牙齿表面的定植是由数量有限的革兰氏阳性物种开始的,主要是绿色类群链球菌[1].这些细菌附着在覆盖矿物表面的宿主唾液成分上,通过生长和物种间的相互作用,形成一个相对简单的生物膜群落(即早期菌斑)。这个群落的成员可以激活宿主细胞,而生物膜本身为其他物种创造了一个栖息地,其中一些物种与龋齿和牙周病的开始和发展密切相关[2].在目前的通信中,我们总结了假设的证据,即某些viridans组链球菌的表面多糖是存在于表现口服生物膜群落的其他成员上的凝集素样粘液的受体。这些组分如何影响生物膜发展的研究可能会对生物膜相关口腔疾病的病因和发病机制提供见解。
早期生物膜的形成涉及菌种数量有限
用于在口腔生物膜形成中定义早期事件的有吸引力的实验模型涉及从4至12小时的时间孵育人口腔中的可检索的牙釉质碎片。在此期间移除芯片的扫描电子显微照片表明,通过将单个微生物与唾液涂覆的矿物表面的附着引发殖民化,并主要通过附着细菌的生长作为扩散微菌根进行[3.].这些微菌落通常由分裂球菌和棒的外周单层和包含多个细菌层的中心区域组成。美国杂志那口腔链球菌和美国缓和的是在同时进行的微生物研究中发现的最显著的物种[2]和一起构成总耕种菌群的大约80%。革兰氏阳性pleomophic棒材多株放线菌naeslundii,由总的另外5%至10%。因此,唾液涂覆的矿物表面的主要定殖涉及相对简单的生物膜社区的生成。
有趣的是,S. Mutans.是人类龋齿的主要代理,通常没有从活跃龋齿的口腔腔内孵育后形成的牙釉质芯片的早期生物膜鉴定[4.].此外,当该物种被发现时,它占早期链球菌总菌群的比例不到2%。在龋齿活跃个体和无龋齿个体的早期菌群中,其他链球菌种类的相对比例存在差异。具体来说,就是美国缓和的普遍升高为代价美国杂志在龋齿活跃的人。这种人口转变的生态后果尚不清楚。然而,它们可以包括从这些链球菌种类的代表性菌株的酸产生的比较研究提出的早期斑块pH降低[5.].更酸性的环境可能反过来有利于连续的织核物种如S. Mutans.,导致龋齿快速发展。因此,口腔疾病的病因和发病机制可能与早期生物膜群落的生态特性有关。
受体多糖的结构基础(RPS)介导的间粘连
促进早期生物膜群落发展的细菌特性可能包括表面黏附素和受体,它们介导了观察到的不同菌株之间的共聚集美国杂志那S. Gordonii那口腔链球菌那美国缓和的和A. Naeslundii[6.].之间的coaggregationsA. Naeslundii和不同的链球菌通常通过将GalNAc或Gal和结果抑制从凝集素样结合A. Naeslundii2型FIMBRIAE以络入的链球菌表面上存在的互补受体。这些受体发生在大多数菌株上口腔链球菌在某些旋律上美国杂志那S. Gordonii和美国缓和的.很多,但不是全部链球菌具有这种受体的细菌也参与与其他菌株的共聚集美国杂志或者S. Gordonii.这些聚集被GalNAc抑制,是由菌株表面粘连蛋白的凝集素样结合所致美国杂志或者S. Gordonii[7.].因此,在生物膜早期的不同成员之间发生广泛的粘合剂相互作用网络。
观察到的不同细菌之间的共聚集的结构基础是明显的糖结合特异性的表面黏附蛋白的菌株A. Naeslundii那美国杂志和S. Gordonii和从互补受体的结构呈现于其它链球菌菌株。的2型菌毛A. Naeslundii,除了用介导的共gggregations链球菌,介导粘附A. Naeslundii到表面结合的宿主糖缀合物[8.那9.].已鉴定出两种不同的受体结构,分别是球糖苷的末端gal β1- 3gal和asialo-的末端Galβ1-3GalNAcO.- 链接糖蛋白和神经节苷脂。与这些发现一致,可溶性Galnacβ1-3Gal-和Galβ1-3galnac配体是有效的抑制剂A. Naeslundii2型菌毛介导的粘附[10.].这些二糖仅在n -乙酰基的位置上有所不同。因此,每一种能力都能抑制束缚A. Naeslundii2型FIMBRIAE可能取决于这些结构的共同特征。Galnac结合表面粘附素美国杂志SK1和S. GordoniiDL1还识别末端Galnacβ1-3Gal[11.].然而,这些粘附素不会结合固定化的甘油蛋白的末端Galβ1-3galNAc。根据这些发现,在菌株之间观察到的共ggrations美国杂志或者S. Gordonii和其他链球菌通过溶解的Galnacβ1-3Gal-比含Galβ1-3GalnaC的配体更有效地抑制[6.].因此,galna β1- 3gal的n -乙酰基对介导这些相互作用的链球菌黏附蛋白的结合至关重要。
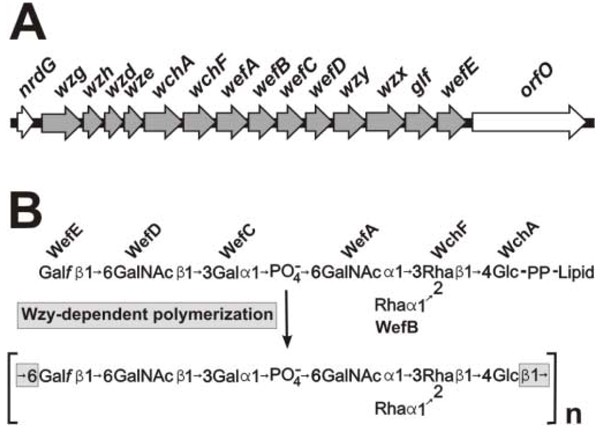
20多个代表性菌株的结构研究美国杂志那S. Gordonii那口腔链球菌和美国缓和的参与2型Fimbriae介导的共gggregationsA. Naeslundii结果鉴定了六种不同的链球菌受体多糖(RPS),每一种都由一个不同的六或七糖重复单元组成(图。1)[12].值得注意的是,主机样受体基序的结合A. Naeslundii2型菌毛出现在每个RPS重复单元内。四种结构型含GalNAcβ1-3Gal (Gn)基序(1Gn、2Gn、4Gn和5Gn),另外两种结构型含Galβ1-3GalNAc (G)基序(2G和3G)。所有具有这些多糖的链球菌都是共聚集的伙伴A. Naeslundii.然而,只有链球菌是熊GN-类型RPS的是共聚集合作伙伴美国杂志SK1和S. GordoniiDL1。这些菌株的GalNAc结合粘附素不识别G型RP。因此,不同链球菌对不同链球菌的GN和G种类型的发生可能影响生物膜发育。
在结构类型之间保守的RPS的其他特征可能有助于这些线性多糖的粘附结合。这些特征包括β1-6联系的灵活性来自GALF.和阴离子磷酸二酯键的侧翼每个识别基序[13那14].该区域中,尽管对于interbacterial粘附关键的,少有助于不同RPS结构类型的抗原性。相反,其它结构特征,例如存在于类型2GN和2G RPS [有rHA分支15]形成抗rps抗体的主要抗原表位。因此,2Gn和2G RPS的反应类似于抗原,但不同于受体。其他结构类型,如1Gn和2Gn RPS反应类似的受体,但不同的抗原。这些发现提出了在口腔生物膜形成过程中产生不同抗原类型的RPS有助于逃避宿主分泌性免疫应答的可能性。然而,在全人类唾液样本中尚未检测到特异性抗rps抗体的存在。因此,需要对这些分子的宿主反应(或缺乏反应)进行进一步的研究。
RPS结构和功能的分子基础
近期分子研究的结果已经确定了六种RPS结构类型中的每种类型的生物合成基因簇。如图2GN型RPS基因簇所示S. Gordonii38(图。2)[16[每个RPS簇的5'-末端含有四种常见的调节基因(即。,WZG.那WZH.那WZD.和w).这些基因的同源物在革兰氏阳性细菌的多糖基因簇中广泛地发生,包括囊状多糖基因簇肺炎链球菌[17].每个RPS基因簇的调控区域后面的基因为合成脂连接,类型特异性RPS重复单元的糖基转移酶。许多基因为糖基转移酶在菌株之间存在很高的同源性S. Gordonii和口腔链球菌[18,表明这些物种之间存在水平基因转移。此外,特定基因的存在或缺失与不同类型RPS之间存在的结构差异密切相关。例如,区分2Gn型RPS和1Gn型RPS的Rha分支依赖于其编码的糖基转移酶wefB该基因存在于2Gn RPS基因簇中S. Gordonii38,但不存在1Gn RPS基因簇口腔链球菌34 (18].同样,不同的相邻基因对,该文和wefD在2Gn簇类型中S. Gordonii38岁,wefF和wefG在2g群集中口腔链球菌J22,解释了这些菌株相应多糖中存在的独特识别基元[19].每个RPS簇中的另外的基因编码推定的翻转酶(WZX),其将脂质连接的重复单元的低聚糖部分传送到细胞质膜的外表面和推定的聚合酶(WZY),其连接重复单元的端部 -结束形成线性多糖链。聚合涉及在每个RP重复的第一糖和最后糖之间形成糖苷键(即。,glcβ1-6gal.F.在1Gn,2Gn和2g rps,glcβ1-3gal类型中F.在3G型RPS和Galβ1-6Gal中F.在4Gn和5Gn rps类型中)。
另外的基因控制了核苷酸连接的糖的合成,其是RPS生物合成的必需前体。其中之一(GLF.)编码半乳糖呋喃糖突变酶,该酶催化udp -半乳糖吡喃糖转化为udp -半乳糖呋喃糖。这种基因总是发生在不同菌株的RPS基因簇中。核苷酸糖生物合成的其他基因的位置因链球菌种类而异。例如,在S. Gordonii38、前三个基因的dTDP-L.-rhamnose生物合成途径(即。,RMLA那rmlC和rmlB)发生在一个单独的操纵子戈尔2.,用于双官能半乳糖脱落酶的基因,其供应UDP-GAL和UDP-Galnac用于多糖生物合成[16].dTDP-的最终基因L.鼠李糖生物合成(即,RMLD.)独立转录,下游RML.-戈尔2.操纵子。相比之下,RMLA那rmlC和rmlBof口腔链球菌菌株34和J22发生在这些菌株的相应1GN和2G RPS基因簇的3'-末端rmlD直接在下游发生,但转录方向相反[19那18].RPS基因集群之间存在的差异S. Gordonii和口腔链球菌的组织和核苷酸序列同源性,提出了有趣的可能性,这些细菌的RPS生产的进化发生在这些物种的分化之后。四种产生rps的口腔链球菌,美国杂志那S. Gordonii那口腔链球菌和美国缓和的,属米提斯族的近亲[20.].该组中,其中包括的成员肺炎链球菌,全部与人类的口腔和上呼吸道密切相关。因此,某些物种作为人口口服生物膜界的成员的演变可能与RPS生产的演变密切相关。RPS结构和功能基因的鉴定为进一步的系统发育研究提供了一种开始基础,以检查这种有趣的可能性。
rps介导的细菌间粘附在生物膜形成中的作用
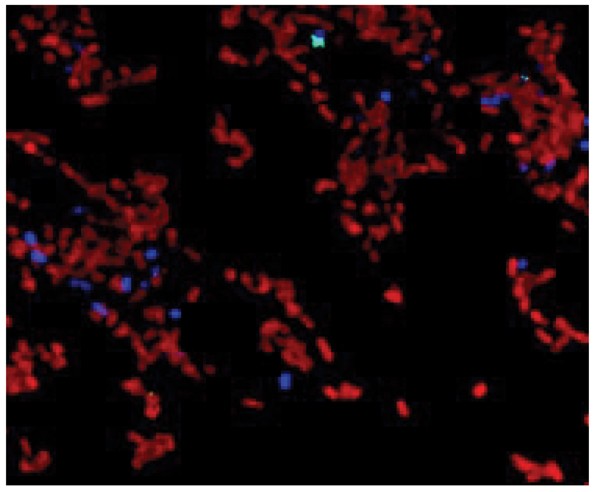
在具有不同的特异性抗体一起进行的激光共聚焦显微镜已经被用于检查RPS-轴承链球菌的分布和2型菌毛A. Naeslundii早期生物膜在可回收牙釉质碎片上的体内形成[21].体内培养8小时后,芯片上可见大量细胞表面RPS标记的细菌。其他的细菌标记有特定的抗体的菌株A. Naeslundii也出席了,但人数少得多。值得注意的是,后者细胞(即。,2型菌毛A. Naeslundii)几乎只存在于产生rps的细菌的微菌落中,因此支持rps介导的细菌间粘附在早期生物膜形成中的作用。此外,A. Naeslundii在牙釉质表面的早期体内定植过程中形成的产生rps的链球菌的单层中已经被确认(图。3.).
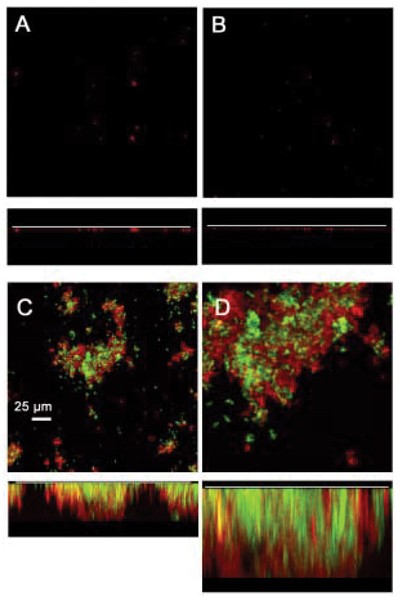
RPS介导的间粘连的生态作用可以是促进食物链的形成和需要在不同细菌之间密切接触的其他互动相互作用。使用这种可能性的这种可能性的证据是使用生物膜形成的流动性模型获得,其中人类唾液是细菌生长的唯一营养素来源[22].在rps制造时,生物膜形成是有限的或在这些条件下没有发生口腔链球菌34或2型迷住A. NaeslundiiT14V分别引入流通池。然而,当这两个菌株一起引入生物膜形成的繁茂混合物种。这些观察结果最近已通过与这些野生型菌株和相应突变体菌株特异性缺乏细胞表面RPS或2型菌毛进行同样的实验的结果延长。正如预期的那样,野生型口腔链球菌34和A. NaeslundiiT14V形成了繁茂的生物膜(图4.).然而,当任一野生型菌株与另一细胞型的非贴壁突变体配对时,生物膜的形成大大减少(即,RPS阴性口腔链球菌34型或2型毛阴性A. NaeslundiiT14V)。因此,rps介导的间粘结粘附似乎促进建立了互联协会之间的口腔链球菌和A. Naeslundii这对于在流动的人类唾液中繁茂生长和混合物种生物膜的形成至关重要。
来自不同个体的RPS产生细菌的特征
鉴定六种结构类型的RPS是基于四种RPS制剂种类的代表性菌株的表征。因此,目前尚不清楚任何一个人的链球菌菌群内发生多少种不同的rps产生的菌株。为了解决这个问题,我们已经开始从个人志愿者表征这些细菌。这涉及通过菌落免疫印迹与RPS特异性抗体的混合物和随后通过用特异性抗体和粘附素的反应进行rPS特异性抗体的菌落和随后表征各个克隆的rps产生克隆。这些研究的初始结果表明,通过迄今为止,每个人的常驻链球菌植物群生产一种主要类型的RP。因此,从一个志愿者生产的22个RPS产生的分离物,所有产生1GN rps,而来自另一个来自另一个单独的型2GN rps的rps产生的分离物。另外,从第三个体产生21个rps产生的分离物,其中包括2gn rps和两种产生1gn rps的两种。基于PCR的基因分型[23],表明每个分离株存在1至3个不同的产生rps的克隆。这些克隆似乎是口腔链球菌或者S. Gordonii基于管家基因的排序[24].不同个体是否RPS-生产克隆如对于菌株已经描述受到更换或随时间染色体重排美国缓和的[25),口腔链球菌[26]仍有待确定。
结论
超过90%的rps产量链球菌从来自每个五个人的早期菌斑的样品中鉴定的类型1GN或2GN RPS产生克隆。这些细菌检查,以日期斑块样品中的优势提出了有关的发生和分布的一些有趣的可能性链球菌产生其他结构类型。显然,一种可能性是,将发现某些个体的链球菌植物群生成2g,3g,4gn或5gn rps,从而表明个体之间的RPS产生显着差异。或者,每个个人的rps制造菌群,包括已经检查的那些,这些植物可能比目前认识到更复杂。如果是这样,链球菌产生1Gn或2Gn RPS以外的结构类型的RPS可能在早期生物膜群落成熟时出现,或可能在其他口腔部位定植时出现。在任何情况下,决定是否生产rps都是很重要的链球菌,特别是那些产生GN和G系的人存在于不同的生物膜社区中。生物膜社区组成的基于RPS的差异将牢固地确定这些多糖在生物膜发育中的识别作用,并可以对生物膜相关口腔疾病的病因和发病机制提供重要的新见解,包括龋齿。
另一个有趣的研究领域涉及到rps生产的自然史链球菌在人类宿主中。可用的结果表明,这些细菌从成年人传播到牙齿喷发后不久的婴儿。然而,尚不清楚常驻RPS的rps-霉菌菌群,一旦获得,是稳定的,或者在每个人的寿命中发生RPS产生克隆的群体是否发生。新的结构类型的RP可以逐渐演变并通过个人之间的传输来传播。或者,可以通过在每个人的居民群中的不同链球菌菌株和物种之间的rps生物合成之间的水平转移来频繁地产生新类型。目前对RPS生产的分子研究旨在区分这些可能性。
参考文献
- 1。
王志强,王志强,王志强:牙釉质和根表面早期定殖的微生物学研究。中国科学(d辑):地球科学(英文版)。
- 2.
长臂猿RJ:口腔组织的细菌粘附:感染性疾病的模型。中国海洋大学学报(自然科学版),2003,21(5):457 - 461。
- 3.
用扫描电子显微镜观察早期微生物在人牙釉质和根表面的定植。中国科学(d辑):地球科学(d辑),1998,16(4):531 - 534。
- 4.
龋齿活跃个体和龋齿不活跃个体牙釉质上最初链球菌菌群的比较。中国生物医学工程学报,2000,24(4):267-272。
- 5.
德索JJ,Nyvad B,Kilian M:口服链球菌的应变相关的酸产生。克赖斯res。2000,34(6):486-490。10.1159 / 000016628。
- 6.
徐志强,王志强,王志强:翠绿菌群链球菌的黏附特性。微生物保健1994,125-137。7.
- 7。
Kolenbrander Pe,安德森·卢尔,摩尔LV:人口腔菌株中的肿瘤凝聚结合:牙齿表面初级定殖中的潜在作用。申请环境微生物。1990,56(12):3890-3894。
- 8。
布伦南MJ,Joralmon RA,Cisar JO,桑德伯格AL:放线naeslundii的绑定到糖脂。感染免疫。1987年,55(2):487-489。
- 9.
Ruhl S,Sandberg Al,Cole Mf,Cisar Jo:口服放射素和链球菌凝集素的免疫球蛋白A1识别。感染免疫。1996,64(12):5421-5424。
- 10。
Cisar Jo,Sandberg Al,Abeygunawardana C,Reddy GP,Bush Ca:凝集凝集链球菌壁壁多糖中的宿主样糖基序的凝集素。糖生物学。1995年,5(7):655-662。
- 11.
Takahashi Y,Ruhl S,Yoon Jw,Sandberg Al,Cisar Jo:viridans Group Streptococci对唾液酸,半乳糖和N-乙酰酰亚胺胺的受体的粘附性。口服微生物免疫酚。2002,17(4):257-262。10.1034 / J.1399-302X.2002.170409.x。
- 12.
Cisar JO, Sandberg AL, Reddy GP, Abeygunawardana C, Bush CA:带有口腔放线菌和链球菌凝集素受体的绿菌群链球菌细胞壁多糖的结构和抗原类型。中华结核和呼吸杂志。1997,65(12):5035-5041。
- 13.
McIntire FC, Crosby LK, Vatter AE, Cisar JO, McNeil MR, Bush CA, Tjoa SS, Fennessey PV:一种从血链球菌34中提取的多糖,可抑制血链球菌34与粘放线菌T14V的共聚集。中国微生物学杂志。1998,17(5):527 - 534。
- 14.
徐Q,灌木CA:基于异核NMR偶联常数的链球菌脑膜炎氏菌菌脉冲壁多糖的分子建模。生物化学。1996,35(46):14521-14529。10.1021 / Bi961262 +。
- 15.
Reddy GP,Abeygunawardana C,灌木CA,Cisar Jo:链球菌的细胞壁多糖38:与链球菌34和链球菌脑膜炎氏菌菌的受体多糖的结构和免疫化学比较。糖生物学。1994,4(2):183-192。
- 16.
徐DQ,Thompson J,Cisar jo:遗传基因群在链球菌38中的凝结受体多糖生物合成.J菌。2003,185(18):5419-5430。10.1128 / jb.185.18.5419-5430.2003。
- 17。
江姆,王L,Reeves Pr:肺炎链球菌型4,6B,8和18C荚膜多糖基因簇的分子表征。感染免疫。2001,69(3):1244-1255。10.1128 / IAI.69.3.1244-1255.2001。
- 18。
Yoshida Y,Ganguly S,Bush Ca,Cisar jo:在链球菌凝结受体多糖中L-rhamnise分支形成的分子基础。J细菌。2006,188(11):4125-4130。10.1128 / jb.01843-05。
- 19。
Yoshida Y,Ganguly S,Bush Ca,Cisar jo:识别术中核酸核水溶液在链球菌共聚受体多糖中的识别基序。mol microbiol。2005,58(1):244-56。10.1111 / J.1365-2958.2005.04820.x。
- 20。
Kawamura Y,Hou Xg,Sultana F,Miura H,Ezaki T:测定链球菌成员中链球菌和链球菌的16S rRNA序列和系统发育关系。int J SYST Bacteriol。1995,45(2):406-408。
- 21。
Palmer RJ,Gordon Sm,Cisar Jo,Kolenbrander PE:在初始人类牙菌斑中检测到的链球菌和放线菌的共gregation介导的相互作用。J细菌。2003,185(11):3400-3409。10.1128 / jb.185.11.3400-3409.2003。
- 22。
帕尔默,卡兹默扎克,韩森,科伦布兰德尔:互惠与独立:以唾液作为唯一营养来源的混合物种体外口腔生物膜策略。中华结核和呼吸杂志。2001,19(9):579 -5804。10.1128 / iai.69.9.5794 - 5804.2001。
- 23。
Alam S,Brailsford SR,Whiley Ra,Beighton D:基于PCR的基因分型Viridans组链球菌方法。J Clar Microbiol。1999,37(9):2772-2776。
- 24.
河村Y,Whiley RA,舒SE,江崎T,哈迪JM:遗传方法链球菌属内的识别的缓症链球菌群。微生物。1999年,145(PT 9):2605至2613年。
- 25.
HohwyĴ,ReinholdtĴ,克里安L:链球菌种群动态和缓在其自然栖息地。感染免疫。2001年,69(10):6055-6063。10.1128 / IAI.69.10.6055-6063.2001。
- 26.
Alam S,Brailsford SR,Adams S,Allison C,Sheehy E,Zoitopoulos L,Kidd EA,Beighton D:链球菌的基因型异质性,人体牙菌斑的嗜酸体斑块和不同的碳酸群。申请环境微生物。2000,66(8):3330-3336。10.1128 / AEM.66.8.3330-3336.2000。
确认
这项工作得到了NIH内部研究项目(NIDCR)的支持。
作者信息
隶属关系
通讯作者
附加信息
竞争利益
提交人声明他们没有竞争利益。
作者的贡献
所有作者均阅读并批准最终手稿。
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
杨建军,杨建军。等等。链球菌受体多糖:用于口服生物膜形成的识别分子。BMC口腔健康6,S12(2006)。https://doi.org/10.1186/1472-6831-6-S1-S12
关键词
- 龋
- 草绿色链球菌组
- 链球菌种类
- 表面丰富的
- 多糖基因簇